题目内容
10.工业上利用催化氧化反应将SO2转化为SO3:2SO2+O2?2SO3.若某温度下,此反应的起始浓度c(SO2)=1.0mol•L-1,c(O2)=1.5mol•L-1,达到平衡后,SO2的转化率为50%,则此温度下该反应的平衡常数K=0.8(mol/L)-1.分析 达到平衡后,SO2的转化率为50%,则转化的SO2的浓度为1.0mol/L×50%=0.5mol/L,则
2SO2+O2?2SO3.
开始 1.0 1.5 0
转化 0.5 0.25 0.5
平衡 0.5 1.25 0.5
结合K为平衡时生成物浓度幂之积与反应物浓度幂之积的比计算.
解答 解:达到平衡后,SO2的转化率为50%,则转化的SO2的浓度为1.0mol/L×50%=0.5mol/L,则
2SO2+O2?2SO3.
开始 1.0 1.5 0
转化 0.5 0.25 0.5
平衡 0.5 1.25 0.5
则K=$\frac{(0.5)^{2}}{(0.5)^{2}×1.25}$=0.8 (mol/L)-1,
故答案为:0.8 (mol/L)-1.
点评 本题考查化学平衡常数及计算,为高频考点,把握化学平衡三段法、各物质的量浓度的关系等为解答的关键,侧重分析与计算能力的考查,注意K与平衡浓度的关系,题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
18.下列叙述错误的是( )
| A. | 带相反电荷离子之间的相互吸引称为离子键 | |
| B. | 金属元素与非金属元素化合时,不一定形成离子键 | |
| C. | 某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键 | |
| D. | 非金属原子间不可能形成离子键,存在离子键的化合物一定是离子化合物 |
15.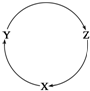 下列各组物质中,不能满足下图物质一步转化关系的选项是( )
下列各组物质中,不能满足下图物质一步转化关系的选项是( )
 下列各组物质中,不能满足下图物质一步转化关系的选项是( )
下列各组物质中,不能满足下图物质一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | NaOH | Na2CO3 | NaHCO3 |
| B | C | CO | CO2 |
| C | Cu | CuSO4 | Cu(OH)2 |
| D | AlCl3 | NaAlO2 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
20.乙醇俗称酒精,具有无毒、易储存、原料来源广泛等优点.以乙醇为原料制作的燃料电池,即乙醇燃料电池,相比于甲醇燃料电池在安全性方面具有很大优势.乙醇燃料电池的总反应式:C2H5OH+3O2→2CO2+3H2O.下列说法不正确的是( )
| A. | C2H5OH在电池的负极上参加反应 | |
| B. | 1 mol乙醇被氧化转移6 mol电子 | |
| C. | 在外电路中电子由负极沿导线流向正极 | |
| D. | 电池正极得电子的物质是O2 |
 ;水溶液PH=8,则C(HY-)+2C(H2Y)=10-6-10-8mol/L(填精确值).
;水溶液PH=8,则C(HY-)+2C(H2Y)=10-6-10-8mol/L(填精确值).