题目内容
18.下列叙述错误的是( )| A. | 带相反电荷离子之间的相互吸引称为离子键 | |
| B. | 金属元素与非金属元素化合时,不一定形成离子键 | |
| C. | 某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键 | |
| D. | 非金属原子间不可能形成离子键,存在离子键的化合物一定是离子化合物 |
分析 A.带相反电荷的离子之间的相互作用称为离子键;
B.金属元素与非金属元素化合时不一定形成离子键,可能形成共价键;
C.最外层只有一个电子,可能是H元素;
D.铵盐是由非金属原子间形成的离子键.
解答 解:A.带相反电荷的离子之间的相互作用称为离子键,相互作用包含吸引力、排斥力,故A错误;
B.金属元素与非金属元素化合时不一定形成离子键,可能形成共价键,如AlCl3,故B正确;
C.最外层只有一个电子,可能是H元素,它跟卤素结合时所形成的化学键是共价键,故C正确;
D.铵盐是由非金属原子间形成的离子键,存在离子键的化合物一定是离子化合物,故D错误;
故选AD.
点评 本题考查离子键、化合物与化学键的关系等知识点,侧重考查基本概念,注意不能根据是否含有金属元素判断离子键,易错选项是B.

练习册系列答案
相关题目
6.下列有关物质的检验或区分方法中不正确的是( )
| A. | 向某溶液中加入BaCl2溶液,有白色沉淀,则原溶液一定存在Ag+或SO42- | |
| B. | 根据纤维在火焰上燃烧产生的气味,可确定该纤维是否为蛋白质纤维 | |
| C. | 两份常温下均为饱和溶液(一份是NaOH溶液,一份是氢氧化钙溶液),上述两份饱和溶液可通过加入少量的NaOH固体而鉴别出 | |
| D. | 某矿石中加入足量的盐酸,根据放出的二氧化碳气体,可证明该矿石一定含有碳酸盐 |
8.下列离子方程式书写正确的是( )
| A. | 硝酸银溶液中加入铜粉:Ag++Cu=Cu2++Ag | |
| B. | 氧化钠投入水中发生反应:O2-+H2O=2OH- | |
| C. | 向澄清石灰水中通入足量二氧化碳:OH-+CO2=HCO3- | |
| D. | 金属铁溶于稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
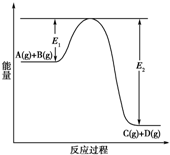 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.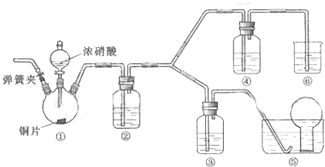
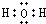 和
和