题目内容
1.W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素.(1)W、X的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(2)W与Y可形成化合物W2Y,该化合物电子式为
 ;水溶液PH=8,则C(HY-)+2C(H2Y)=10-6-10-8mol/L(填精确值).
;水溶液PH=8,则C(HY-)+2C(H2Y)=10-6-10-8mol/L(填精确值).(3)将Y的低价氧化物通入W的最高价氧化物对应水化物中,经充分反应后,所得溶液呈中性,则混合溶液中的溶质主要为Na2SO3、NaHSO3;溶液中C(W+)=2c(SO32-)+c(HSO3-).
(4)常温下,pH=10的碱WOH和pH=4的酸HnYO3等体积混合后溶液显酸性,生成的盐化学式为NaHSO3.WOH与HnYO3完全中和所得溶液呈碱性,其原因用离子方程式表示SO32-+H2O?HSO3-+OH-.
分析 W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素,
(1)W、X是金属元素,W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,则W为Na,X为Al;
(2)W与Y可形成化合物W2Y,该化合物为Na2S,硫化钠是钠离子和硫离子间通过离子键形成的离子化合物;根据物料守恒和电荷守恒计算;
(3)S的低价氧化物为二氧化硫,与NaOH溶液反应可以生成Na2SO3或NaHSO3,Na2SO3溶液显碱性,NaHSO3溶液显酸性;根据电荷守恒计算;
(4)常温下,pH=10的碱NaOH和pH=4的酸H2SO3等体积混合后溶液显酸性,说明生成NaHSO3;Na2SO3溶液显碱性,亚硫酸根离子水解生成氢氧根离子.
解答 解:在短周期元素中,第二周期和第三周期的前面元素是金属,后面元素是非金属,
(1)(1)W、X是金属元素,W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,则W为Na,X为Al,氢氧化铝是两性氢氧化物,能和强碱反应生成盐和水,该反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)W与Y可形成化合物W2Y,则 Y是非金属硫,硫化钠使钠离子和硫离子间通过离子键形成的离子化合物,电子式为: ;
;
Na2S溶液中存在物料守恒为c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),电荷守恒为c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),
则c(HS-)+2c(H2S)=c(OH-)-c(H+)=10-6-10-8mol/L
故答案为: ;10-6-10-8mol/L;
;10-6-10-8mol/L;
(3)S的低价氧化物为二氧化硫,与NaOH溶液反应可以生成Na2SO3或NaHSO3,Na2SO3溶液显碱性,NaHSO3溶液显酸性,已知溶液显中性,说明是二者的混合物,所以溶液中溶质为Na2SO3、NaHSO3;溶液中电荷守恒为c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),已知c(H+)=c(OH-),则c(Na+)=2c(SO32-)+c(HSO3-)
故答案为:Na2SO3、NaHSO3;2c(SO32-)、c(HSO3-);
(4)常温下,pH=10的碱NaOH和pH=4的酸H2SO3等体积混合后溶液显酸性,已知Na2SO3溶液显碱性,NaHSO3显酸性,说明生成NaHSO3;Na2SO3溶液显碱性,是因为亚硫酸根离子水解生成氢氧根离子,其水解方程式为:SO32-+H2O?HSO3-+OH-;
故答案为:NaHSO3;碱;SO32-+H2O?HSO3-+OH-.
点评 本题考查位置、结构、性质的关系,熟悉第三周期元素的性质变化规律及常见元素的单质和化合物的性质是解答本题的关键,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

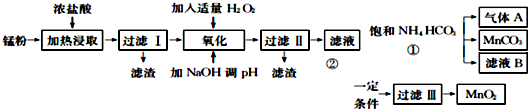
已知几种氢氧化物开始沉淀和完全沉淀的pH如表:
| 氢氧化物 | Fe(OH) | Fe(OH) | Mn0H)2 | Zn(OH)2 |
| 开始沉淀的pH | 7.5 | 2.2 | 8.8 | 6.4 |
| 沉淀完全的pH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤工得到的滤渣主要成分是碳黑.
(2)滤液经氧化后加入NaOH溶液调节pH至8.5〜8.8,其目的是除去Fe3+、Zn2+.
(3)过滤Ⅱ得到的滤液中含有的阳离子主要是Mn2+、NH4+、Na+(填离子符号).
(4)过程①中发生反应的离子方程式为Mn2++2HCO3-=MnCO3+CO2↑+H2O,对气体A和滤液B应采取的处理方法分别是CO2循环利用,用于生产NH4HCO3;滤液B中含有NH4Cl,可分离用作氮肥.
(5)过程②得到MnO2.将MnO2成悬浊液,通S02还原可得MnSO4,再加入Na2CO3或NaHCO3,也可制备MnCO3.SO2还原MnO2的化学方程式为MnO2+S02=MnSO4,向MnS04溶液中加入Na2C03或NaHC03制备MnC03时应注意的问题是边搅拌边加入Na2C03或NaHC03,并控制溶液的pH<8.8.
| A. | 向某溶液中加入BaCl2溶液,有白色沉淀,则原溶液一定存在Ag+或SO42- | |
| B. | 根据纤维在火焰上燃烧产生的气味,可确定该纤维是否为蛋白质纤维 | |
| C. | 两份常温下均为饱和溶液(一份是NaOH溶液,一份是氢氧化钙溶液),上述两份饱和溶液可通过加入少量的NaOH固体而鉴别出 | |
| D. | 某矿石中加入足量的盐酸,根据放出的二氧化碳气体,可证明该矿石一定含有碳酸盐 |
| A. | 氢 | B. | 钠 | C. | 铁 | D. | 氯 |
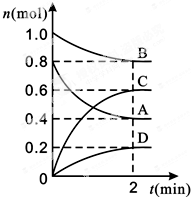 T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:
T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题: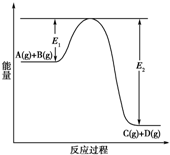 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.