题目内容
3.将100mL1.0mol•L-1H2SO4溶液和100mL2.0mol•L-1CuSO4溶液混合(假设混合后溶液的体积等于混合前两种溶液的体积之和),计算:(1)混合溶液中CuSO4的物质的量浓度
(2)混合溶液中SO42-的物质的量浓度.
分析 根据n=cV计算原硫酸铜溶液中硫酸铜的物质的量,硫酸溶液中硫酸的物质的量,
(1)根据c=$\frac{n}{V}$计算混合溶液中CuSO4的物质的量浓度;
(2)计算硫酸根的总的物质的量,再根据c=$\frac{n}{V}$计算混合溶液中SO42-的物质的量浓度.
解答 解:混合前:n( CuSO4)=2.0mol/L×0.1L=0.2mol,n(H2SO4)=l.0mol/L×0.1L=0.1mol.
(1)混合后溶液的体积为0.2L,c(CuSO4)=$\frac{0.2mol}{0.2L}$=1mol/L,
答:混合溶液中CuSO4的物质的量浓度为1mol/L;
(2)混合后:n(SO42-)=n( CuSO4)+n(H2SO4)=0.2mol+0.1mol=0.3mol,混合后c(SO42-)=$\frac{0.3mol}{0.2L}$=1.5mol/L;
答:混合溶液中SO42-的物质的量浓度为1.5mol/L.
点评 本题考查物质的量浓度的相关计算,题目难度不大,注意相关计算公式的运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.面对日益严重的资源短缺及环境污染问题,“变废为宝”成为化学发展的新方向.废旧酸性锌锰干电池经分离破碎后的锰粉含Mn02、Mn0(0H)、Zn(NH3)CL2、Fe、NH4C1和炭黑等,可用于制取Mn02高性能磁性材料MnC03,其工艺流程如下:
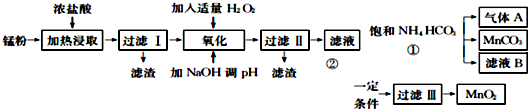
已知几种氢氧化物开始沉淀和完全沉淀的pH如表:
回答下列问题:
(1)过滤工得到的滤渣主要成分是碳黑.
(2)滤液经氧化后加入NaOH溶液调节pH至8.5〜8.8,其目的是除去Fe3+、Zn2+.
(3)过滤Ⅱ得到的滤液中含有的阳离子主要是Mn2+、NH4+、Na+(填离子符号).
(4)过程①中发生反应的离子方程式为Mn2++2HCO3-=MnCO3+CO2↑+H2O,对气体A和滤液B应采取的处理方法分别是CO2循环利用,用于生产NH4HCO3;滤液B中含有NH4Cl,可分离用作氮肥.
(5)过程②得到MnO2.将MnO2成悬浊液,通S02还原可得MnSO4,再加入Na2CO3或NaHCO3,也可制备MnCO3.SO2还原MnO2的化学方程式为MnO2+S02=MnSO4,向MnS04溶液中加入Na2C03或NaHC03制备MnC03时应注意的问题是边搅拌边加入Na2C03或NaHC03,并控制溶液的pH<8.8.

已知几种氢氧化物开始沉淀和完全沉淀的pH如表:
| 氢氧化物 | Fe(OH) | Fe(OH) | Mn0H)2 | Zn(OH)2 |
| 开始沉淀的pH | 7.5 | 2.2 | 8.8 | 6.4 |
| 沉淀完全的pH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤工得到的滤渣主要成分是碳黑.
(2)滤液经氧化后加入NaOH溶液调节pH至8.5〜8.8,其目的是除去Fe3+、Zn2+.
(3)过滤Ⅱ得到的滤液中含有的阳离子主要是Mn2+、NH4+、Na+(填离子符号).
(4)过程①中发生反应的离子方程式为Mn2++2HCO3-=MnCO3+CO2↑+H2O,对气体A和滤液B应采取的处理方法分别是CO2循环利用,用于生产NH4HCO3;滤液B中含有NH4Cl,可分离用作氮肥.
(5)过程②得到MnO2.将MnO2成悬浊液,通S02还原可得MnSO4,再加入Na2CO3或NaHCO3,也可制备MnCO3.SO2还原MnO2的化学方程式为MnO2+S02=MnSO4,向MnS04溶液中加入Na2C03或NaHC03制备MnC03时应注意的问题是边搅拌边加入Na2C03或NaHC03,并控制溶液的pH<8.8.
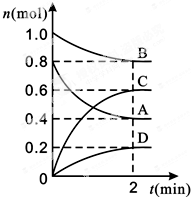 T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:
T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题: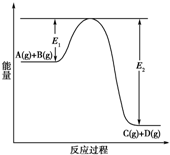 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.