题目内容
16.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物溶于水后溶液呈碱性;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$,下列说法正确的是( )| A. | 简单离子的半径:W>Z>Y>X | |
| B. | W和M形成的化合物是离子化合物 | |
| C. | 五种元素中只有X存在同素异形体 | |
| D. | 工业上采用电解W和Z形成的化合物制备W单质 |
分析 X、Y、Z、M、W为五种短周期元素.Y与M形成的气态化合物溶于水后溶液呈碱性,则Y为N元素,M为H元素;X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子,则均为第二周期元素,X为C,Z为O;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$,W的质子数为(6+7+8+1)×$\frac{1}{2}$=11,可知W为Na,然后结合元素周期律及元素化合物知识来解答.
解答 解:X、Y、Z、M、W为五种短周期元素.Y与M形成的气态化合物溶于水后溶液呈碱性,则Y为N元素,M为H元素;X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子,则均为第二周期元素,X为C,Z为O;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$,W的质子数为(6+7+8+1)×$\frac{1}{2}$=11,可知W为Na,
A.具有相同电子排布的离子,原子序数大的离子半径小,则简单离子的半径:X>Y>Z>W,故A错误;
B.W和M形成的化合物NaH,只含离子键,是离子化合物,故B正确;
C.C、N、O均存在同素异形体,故C错误;
D.W为Na,工业上利用电解熔融NaCl得到Na,W和Z形成的化合物为氧化钠或过氧化钠,故D错误;
故选B.
点评 本题考查位置、结构、性质的关系,为高频考点,把握元素的位置、原子结构推断元素为解答的关键,侧重分析与推断能力的考查,注意元素周期律及元素化合物知识的应用,题目难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
6.短周期元素X、Y、Z、Q、T的原子序数与其常见化合价关系如图.下列说法正确的是( )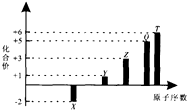

| A. | 1 mol TX2与足量X2反应生成TX3的分子数目为NA | |
| B. | Z元素形成的可溶性盐溶液可能显碱性 | |
| C. | 1 mol Y2X2与足量H2O反应转移的电子数目为2NA | |
| D. | 0.1 molQ元素的含氧酸在水中电离出的H十数目为3NA |
7. 25℃时,取浓度均为0.1mol•L-1的醋酸和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示(已知:醋酸铵溶液呈中性).下列说法正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示(已知:醋酸铵溶液呈中性).下列说法正确的是( )
 25℃时,取浓度均为0.1mol•L-1的醋酸和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示(已知:醋酸铵溶液呈中性).下列说法正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示(已知:醋酸铵溶液呈中性).下列说法正确的是( )| A. | 曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)=c(NH4+)+c(NH3•H2O) | |
| B. | 曲线Ⅰ:滴加溶液到10 mL时:2 c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-) | |
| C. | 曲线Ⅱ:滴加溶液>20 mL时一定符合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 滴加过程中,当pH=7时滴加的两种溶液体积都在10-20 mL之间,但不相等 |
4.已知25℃时,有关弱酸的电离平衡常数:
则下列有关说法不正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A. | NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)-c(OH-)=c(HCO3-)+2c(CO32-) | |
| B. | 25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 | |
| C. | 25℃时,若同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则 c(Na+)-c(CH3COO-)=9.9×10-7mol/L | |
| D. | 25℃时,0.1mol/L的各溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
1.烷烃的系统命名法是我国化学学会根据IUPAC并结合我国汉字使用习惯而制定的,其规定必然遵循我们的认知习惯.包括从选主链定“主基调”,给支键编号定坐标,不同基,从简到繁等.这样易辨易写,边读边辨. 在系统命名法中,下列碳原子主链名称不是丁烷的是( )
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)3CCH2CH3 |
8.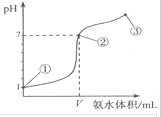 常温下,向20mL某浓度的盐酸中逐滴加入0.1mol.L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是( )
常温下,向20mL某浓度的盐酸中逐滴加入0.1mol.L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是( )
 常温下,向20mL某浓度的盐酸中逐滴加入0.1mol.L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是( )
常温下,向20mL某浓度的盐酸中逐滴加入0.1mol.L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是( )| A. | 用0.1mol/LNa0H溶液代替氨水滴定盐酸达到点②时所消耗的Na0H的体积也是VmL | |
| B. | 从开始滴定后的任意一点:溶液中一定存在c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 从点①到点③的滴定过程中:水的电离程度都增大 | |
| D. | 在点②所示溶液中:c(Cl-)=c(NH4+)>c(H+),且V=20 |
8.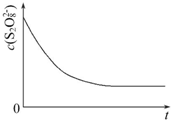 碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O82-+2I-═2SO42-+I2(慢) I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<2.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中Vx2.0 mL,理由是保证反应物K2S2O8浓度改变,而其他的条件不变,才能达到实验目的.
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s)═2LiI(s)△H
已知:①4Li(s)+O2(g)═2Li2O(s)△H1
②4LiI(s)+O2(g)═2I2(s)+2Li2O(s)△H2
则电池反应的△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$;碘电极作为该电池的正极.
 碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:S2O82-+2I-═2SO42-+I2(慢) I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<2.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s)═2LiI(s)△H
已知:①4Li(s)+O2(g)═2Li2O(s)△H1
②4LiI(s)+O2(g)═2I2(s)+2Li2O(s)△H2
则电池反应的△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$;碘电极作为该电池的正极.
 原子序数依次增大的前四周期元素 A、B、C、D、E中,A 和 C 的最外层电子数相同,B 的电负性是所有元素中最大的元素,C 的电子层数等于最外层电子数,D 的最外层电子数在本周期中除稀有气体外最多的原子,E 元素核外电子排布为[Ar]3d104s1.
原子序数依次增大的前四周期元素 A、B、C、D、E中,A 和 C 的最外层电子数相同,B 的电负性是所有元素中最大的元素,C 的电子层数等于最外层电子数,D 的最外层电子数在本周期中除稀有气体外最多的原子,E 元素核外电子排布为[Ar]3d104s1.