题目内容
20.某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O.该反应物中还原产物是NO;若反应方程式中转移了0.4mol电子,则氧化产物的质量是6.4 g.分析 硝酸具有强氧化性,H2S具有较强还原性,二者反应氧化还原反应,故NO为还原产物、S为氧化产物,根据电子转移守恒计算S的物质的量,再根据m=nM计算S的质量,由此分析解答.
解答 解:硝酸具有强氧化性,H2S具有较强还原性,二者反应氧化还原反应,故NO为还原产物、S为氧化产物,若反应过程中转移了0.4mol电子,由电子转移守恒,可知生成S的物质的量=$\frac{0.4mol}{2}$=0.2mol,故生成S的质量=0.2mol×32g/mol=6.4g,
故答案为:NO;6.4.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及计算的考查,注意硝酸、硫化氢的性质,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列物质能使潮湿的有色布条褪色的是( )
| A. | HCl | B. | NaCl | C. | CO2 | D. | 干燥的氯气 |
8.化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下列是一些化学键的键能,根据键能数据估算反应CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热△H为:( )
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +485 kJ•mol-1 | B. | -485 kJ•mol-1 | C. | +1940 kJ•mol-1 | D. | -1940 kJ•mol-1 |
15.下列化学反应过程不符合如图关系的是( )
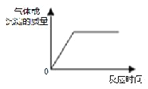

| A. | 向一定量铜片中加入过量浓硝酸 | |
| B. | .向一定量AlCl3溶液通入过量NH3 | |
| C. | .向一定量澄清石灰水中通入过量CO2 | |
| D. | .向一定量MgCl2溶液中滴加过量NaOH |
5.下列两种化合物互为同分异构体的是( )
①蔗糖与麦芽糖
②甲醚(C2H6O)与 乙醇
③淀粉与纤维素
④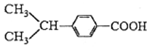 与
与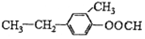
①蔗糖与麦芽糖
②甲醚(C2H6O)与 乙醇
③淀粉与纤维素
④
 与
与
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
12.Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑.对此反应下列说法中正确的是( )
| A. | 2 mol FeSO4发生反应时,反应中共有10 mol电子转移 | |
| B. | 每生成16g氧气就有1molFe2+被还原 | |
| C. | Na2O2只作氧化剂 | |
| D. | 氧化产物只有Na2FeO4 |
5.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 L 0.1 mol/L的NaHSO3溶液中含HSO3-的数目为0.1NA | |
| B. | 已知2SO2(g)+O2(g)?2SO3(g)△H=-196.6 kJ/mol,则将1 mol SO2与足量O2混合后充分反应放出的热量为98.3 kJ | |
| C. | 惰性电极电解硫酸铜的溶液,当阳极生成6.4 g铜时,阴极产生的气体在标准状况下为1.12 L | |
| D. | 金属发生吸氧腐蚀时,消耗1 mol O2,转移电子数为4NA |
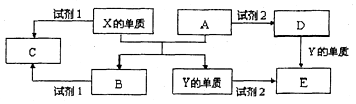 A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.