题目内容
8.四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,Y、W同主族且能形成两种常见的化合物,X、W质子数之和是Z质子数的2倍.则下列说法中正确的是( )| A. | 原子半径比较:X<Y<Z<W | |
| B. | Y的氢化物沸点高于W的氢化物 | |
| C. | Y的氢化物稳定性一定弱于W的氢化物 | |
| D. | 短周期所有元素中,w的最高价氧化物的水化物酸性最强 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;Y、W同主族且能形成两种常见的化合物,则Y为O元素、W为S元素;X、W质子数之和是Z质子数的2倍,则Z的质子数为$\frac{6+16}{2}$=11,故Z为Na.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;Y、W同主族且能形成两种常见的化合物,则Y为O元素、W为S元素;X、W质子数之和是Z质子数的2倍,则Z的质子数为$\frac{6+16}{2}$=11,故Z为Na.
A.同周期随原子序数增大原子半径减小,一般电子层越多原子半径越大,故原子半径O<C<S<Na,即Y<X<W<Z,故A错误;
B.水分子之间存在氢键,常温下为液态,沸点高于硫化氢的,故B正确;
C.过氧化氢易分解,但氧元素非金属性比硫的强,水的稳定性比较硫化氢的强,故C错误;
D.短周期所有元素中,Cl元素的最高价氧化物的水化物酸性最强,故D错误,
故选:B.
点评 本题考查结构性质位置关系应用,根据原子结构特点与Y、W同主族可以形成两种常见化合物推断元素,注意氢键对物质性质的影响,难度中等.

练习册系列答案
相关题目
18.下列物质中,不能电离出酸根离子的是( )
| A. | Na2CO3 | B. | KMnO4 | C. | KOH | D. | H2SO4 |
19.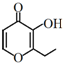 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | lmol该有机物最多能与2molH2发生加成反应 | |
| B. | 该有机物的分子式为C7H8O3 | |
| C. | 该有机物能发生取代反应、加成反应、消去反应和氧化反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
16.单质铜及其化合物一般都具有特殊的颜色,如
某学校学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O,进行了认真的研究.
Ⅰ.查阅资料得出下列信息:
①Cu2O属于碱性氧化物; ②高温灼烧CuO生成Cu2O;
③Cu2O在酸性条件下能发生反应:Cu2O+2H+═Cu+Cu2++H2O.
Ⅱ.设计实验方案:
方案1:取该红色固体溶于足量的稀硝酸中,观察溶液颜色变化.
方案2:取该红色固体溶于足量的稀硫酸中,观察溶液是否呈蓝色.
方案3:称得干燥坩埚的质量为a g,取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g.
(1)写出Cu2O与稀硝酸反应的化学方程式:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O.
(2)请你评价方案1和方案2的合理性,并简述理由:
方案1:不合理,因为铜和氧化亚铜均可溶于稀硝酸形成蓝色溶液.
方案2:合理,因为氧化亚铜与稀硫酸生成Cu和Cu2+,导致溶液呈蓝色.
(3)方案3中,若确认红色固体中含有Cu2O,则a、b、c的关系为c<$\frac{9b-a}{8}$,在该实验方案中最少应进行4次称量.
Ⅲ.学习小组乙设计了新的探究方案,拟根据干燥管中无水硫酸铜是否变蓝判断红色固体中是否含有Cu2O,装置如图所示.

(4)该探究方案中检验气体发生装置气密性的方法为:关闭活塞,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置漏气;(说明操作方法、现象和结论).
(5)为确保探究的科学、合理和安全,你认为实验中还应采取的措施有ABC(填序号).
A.在氢气发生装置与硬质玻璃管之间增加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有无水硫酸铜的干燥管后再连接一个装有碱石灰的干燥管.
| Cu | Cu2O | CuO | Cu(OH)2 | CuSO4•5H2O |
| 红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |
Ⅰ.查阅资料得出下列信息:
①Cu2O属于碱性氧化物; ②高温灼烧CuO生成Cu2O;
③Cu2O在酸性条件下能发生反应:Cu2O+2H+═Cu+Cu2++H2O.
Ⅱ.设计实验方案:
方案1:取该红色固体溶于足量的稀硝酸中,观察溶液颜色变化.
方案2:取该红色固体溶于足量的稀硫酸中,观察溶液是否呈蓝色.
方案3:称得干燥坩埚的质量为a g,取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g.
(1)写出Cu2O与稀硝酸反应的化学方程式:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O.
(2)请你评价方案1和方案2的合理性,并简述理由:
方案1:不合理,因为铜和氧化亚铜均可溶于稀硝酸形成蓝色溶液.
方案2:合理,因为氧化亚铜与稀硫酸生成Cu和Cu2+,导致溶液呈蓝色.
(3)方案3中,若确认红色固体中含有Cu2O,则a、b、c的关系为c<$\frac{9b-a}{8}$,在该实验方案中最少应进行4次称量.
Ⅲ.学习小组乙设计了新的探究方案,拟根据干燥管中无水硫酸铜是否变蓝判断红色固体中是否含有Cu2O,装置如图所示.

(4)该探究方案中检验气体发生装置气密性的方法为:关闭活塞,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置漏气;(说明操作方法、现象和结论).
(5)为确保探究的科学、合理和安全,你认为实验中还应采取的措施有ABC(填序号).
A.在氢气发生装置与硬质玻璃管之间增加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有无水硫酸铜的干燥管后再连接一个装有碱石灰的干燥管.
13.下列关于金属元素特征的叙述,正确的是( )
①金属元素的原子只有还原性,离子只有氧化性
②金属元素在化合物中一般显正价
③金属性越强的元素相应的离子氧化性越弱
④金属元素的原子最外层电子数都少于4.
①金属元素的原子只有还原性,离子只有氧化性
②金属元素在化合物中一般显正价
③金属性越强的元素相应的离子氧化性越弱
④金属元素的原子最外层电子数都少于4.
| A. | ①②③ | B. | ②③ | C. | ①③④ | D. | 全部 |
20.工业利用冶铜炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制Fe2O3的生产流程示意图如下:
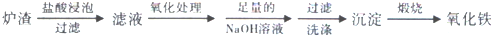
经“足量的NaOH溶液”处理后,铝元素的存在形态为( )
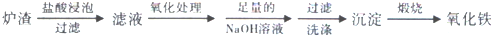
经“足量的NaOH溶液”处理后,铝元素的存在形态为( )
| A. | Al | B. | Al(OH)3 | C. | Al3+ | D. | [Al(OH)4]- |
17.某有机物的结构简式为HO-CH2CH=CHCH2-COOH.下列说法不正确的是( )
| A. | 它能与Na、NaOH、NaHC03等物质反应 | B. | 它能发生酯化、氧化、加成等反应 | ||
| C. | 该有机物分子式为C5H8O3 | D. | 它是乙酸也是乙醇的同系物 |
18.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Y的轨道表示式为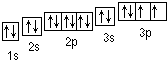 ;
;
(2)X、Y、Z三种元素的原子半径从大到小的顺序是S>Cl>C(用元素符号表示);
(3)XY2的分子中存在2个σ键,分子的空间构形为直线形,在H-Y、H-Z两种共价键中,键长较长的是H-S;
(4)W3+的核外电子排布式是1s22s22p63s23p63d5;
(5)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.此反应的化学方程式是2CO+SO2=S+2CO2;
(6)请设计一个实验方案,比较Y、Z单质氧化性的强弱在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为56,中子数为30 |
 ;
;(2)X、Y、Z三种元素的原子半径从大到小的顺序是S>Cl>C(用元素符号表示);
(3)XY2的分子中存在2个σ键,分子的空间构形为直线形,在H-Y、H-Z两种共价键中,键长较长的是H-S;
(4)W3+的核外电子排布式是1s22s22p63s23p63d5;
(5)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.此反应的化学方程式是2CO+SO2=S+2CO2;
(6)请设计一个实验方案,比较Y、Z单质氧化性的强弱在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
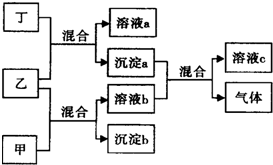 现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液.现进行如下实验,并记录部分现象(如图):
现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液.现进行如下实验,并记录部分现象(如图):