题目内容
13.有KAl(SO4)2和K2SO4的混合溶液aL将它均分成两份,一份滴加BaCl2稀溶液,使SO42-离子完全沉淀,另一份滴加KOH溶液,使Al3+离子先沉淀后又恰好溶解,反应中消耗xmolBaCl2、ymolKOH,据此得知原混合溶液中的c(K+)/mol•L-1为( )| A. | $\frac{4x-2y}{a}$ | B. | $\frac{2x-y}{a}$ | C. | $\frac{8x-3y}{2a}$ | D. | $\frac{8x-3y}{a}$ |
分析 根据反应Ba2++SO42-=BaSO4↓可知硫酸铝钾和硫酸钾中硫酸根离子的总物质的量,根据反应Al3++4OH-=AlO2-+2H2O可知铝离子的物质的量,从而可知硫酸铝钾中硫酸根离子的物质的量,然后计算出硫酸钾的物质的量,根据硫酸钾的化学式可计算出钾离子的物质的量,再根据c=$\frac{n}{V}$计算出原混合溶液中的c(K+).
解答 解:SO42-离子完全沉淀的反应为:Ba2++SO42-=BaSO4↓,消耗了xmolBaCl2,则每份混合液中含有SO42-的总物质的量为xmol,
另一份滴加KOH溶液,使Al3+离子先沉淀后又恰好溶解,反应的总离子方程式为:Al3++4OH-=AlO2-+2H2O,消耗了ymol KOH,则每份溶液中含有KAl(SO4)2的物质的量为ymol×$\frac{1}{4}$=0.25ymol,每份溶液中KAl(SO4)2含有硫酸根离子的物质的量为:0.25ymol×2=0.5ymol,
所以每份溶液中含有K2SO4的物质的量为:xmol-0.5ymol=(x-0.5y)mol,每份溶液中含有钾离子的物质的量为:(x-0.5y)mol×2=(2x-y)mol,
所以原混合溶液中的钾离子的浓度为:c(K+)=$\frac{(2x-y)mol}{\frac{a}{2}L}$=$\frac{4x-2y}{a}$mol/L,
故选A.
点评 本题考查混合物的有关计算、物质的量浓度的计算等,题目难度中等,明确发生的离子反应及溶液不显电性是解答本题的关键,注意熟悉物质的量浓度的计算公式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.某无色溶液能与镁反应放出氢气,此溶液中可能大量共存的离子组是( )
| A. | NH4+、Mg2+、SO42-、Cl- | B. | Fe3+、K+、Cl-、NO3- | ||
| C. | K+、Ba2+、NO3-、SO42- | D. | Na+、NH4+、Cl-、CO32- |
1.锌是微量元素的一种,在人体内的含量以及每天所需的摄入量都很少,但对机体发育及大脑发育有关.因此儿童生长发育时期测量体内含锌量已成为体格检查的重要内容之一,其中比较简单的一种检测方法是取儿童的头发约50g,放在核反应堆中经中子轰击后,头发中的锌元素与中子反应生成具有放射性同位素锌,其核反应方程式为${\;}_{30}^{64}$Zn+${\;}_{0}^{1}$n→${\;}_{30}^{65}$Zn,${\;}_{30}^{65}$Zn衰变放射出能量为1115eV的γ射线,通过测量γ射线的强度可以计算出头发中锌的含量,关于以上叙述,下列说法正确的是( )
| A. | 产生${\;}_{30}^{65}$Zn的反应是聚变反应 | |
| B. | ${\;}_{30}^{64}$Zn和${\;}_{30}^{65}$Zn具有相同的质子数 | |
| C. | ${\;}_{30}^{65}$Zn衰变放射出γ射线时,发生质量亏损,质量亏损并不意味着质量被消灭 | |
| D. | γ射线在真空中传播的速度是3.0×108m/s | |
| E. | γ射线是由于锌原子的内层电子激发产生的 |
8.用接触法制5t98%的浓硫酸,在理论上需要FeS270%(杂质不含碳元素)的硫铁矿为( )
| A. | 86t | B. | 8.6t | C. | 4.3t | D. | 43t |
3.根据教材中提供的制硝基苯的反应: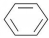 +HNO3(浓)$\frac{\underline{\;\;\;浓硫酸\;\;\;}}{50~60℃}$
+HNO3(浓)$\frac{\underline{\;\;\;浓硫酸\;\;\;}}{50~60℃}$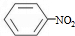 +H2O设计一个实验制取一定量的纯净硝基苯.有关信息见下表:
+H2O设计一个实验制取一定量的纯净硝基苯.有关信息见下表:
可供选择的实验用品:
①仪器:烧杯、大试管、铁架台(带铁夹和铁圈)、石棉网、酒精灯、橡胶塞、玻璃管、温度计、分液漏斗、蒸馏烧瓶、冷凝管、牛角管、锥形瓶等.
②药品:浓硝酸、稀硝酸、浓硫酸、稀硫酸、苯、5%NaOH溶液、无水氯化钙、蒸馏水等.
第一步:选择合适的实验仪器及条件.
(1)请补充完整下列制取硝基苯的装置图(要求注明所画出玻璃仪器名称).

(2)为了防止反应过程中有毒物质挥发到空气中,本装置中使用了长玻璃导管(填仪器名称).所起到的作用是冷凝回流.
第二步:安排合理的实验步骤.
(3)连接装置,检查装置气密性,加入药品,加热反应至实验完成.
第三步:产品提纯.根据上述提供仪器及药品设计实验得到纯净干燥的硝基苯.
(4)简要写出下列各步操作:
问题分析:
(5)纯净的硝基苯是一种有苦杏仁味的无色液体,而实验中得到的产品往往呈淡黄色,可能的原因是含有少量硝酸分解产生的二氧化氮.
 +HNO3(浓)$\frac{\underline{\;\;\;浓硫酸\;\;\;}}{50~60℃}$
+HNO3(浓)$\frac{\underline{\;\;\;浓硫酸\;\;\;}}{50~60℃}$ +H2O设计一个实验制取一定量的纯净硝基苯.有关信息见下表:
+H2O设计一个实验制取一定量的纯净硝基苯.有关信息见下表:| 物质 | 熔点/℃ | 沸点/℃ | 相对密度/(20℃) | 毒性 | 水溶性 |
| 苯 | 5.5 | 80.1 | 0.8794 | 有 | 不溶于水 |
| 硝酸 | -41.59 | 83 | 1.503 | - | 易溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 有 | 不溶于水 |
| 硫酸 | 10.0 | 338 | 1.84 | - | 易溶于水 |
①仪器:烧杯、大试管、铁架台(带铁夹和铁圈)、石棉网、酒精灯、橡胶塞、玻璃管、温度计、分液漏斗、蒸馏烧瓶、冷凝管、牛角管、锥形瓶等.
②药品:浓硝酸、稀硝酸、浓硫酸、稀硫酸、苯、5%NaOH溶液、无水氯化钙、蒸馏水等.
第一步:选择合适的实验仪器及条件.
(1)请补充完整下列制取硝基苯的装置图(要求注明所画出玻璃仪器名称).

(2)为了防止反应过程中有毒物质挥发到空气中,本装置中使用了长玻璃导管(填仪器名称).所起到的作用是冷凝回流.
第二步:安排合理的实验步骤.
(3)连接装置,检查装置气密性,加入药品,加热反应至实验完成.
第三步:产品提纯.根据上述提供仪器及药品设计实验得到纯净干燥的硝基苯.
(4)简要写出下列各步操作:
| 1 | 用蒸馏水洗涤反应混合液,分液后取下层液体 |
| 2 | |
| 3 | |
| 4 | |
| 5 |
(5)纯净的硝基苯是一种有苦杏仁味的无色液体,而实验中得到的产品往往呈淡黄色,可能的原因是含有少量硝酸分解产生的二氧化氮.
7.高中化学学习过程中的物质颜色是需要注意的.下列关于颜色的描述正确的个数是
①氯水放久了会逐渐由黄绿色变成几乎无色
②AgBr见光分解会生成浅黄色的银
③KI溶液中加入淀粉溶液会变成紫色
④碘水中加入CCl4振荡静置后,CCl4层紫红色
⑤氢气能在氯气中燃烧,火焰为黄色( )
①氯水放久了会逐渐由黄绿色变成几乎无色
②AgBr见光分解会生成浅黄色的银
③KI溶液中加入淀粉溶液会变成紫色
④碘水中加入CCl4振荡静置后,CCl4层紫红色
⑤氢气能在氯气中燃烧,火焰为黄色( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
8.下列检验Fe3+的方法错误的是( )
| A. | 加入NaOH溶液,生成灰白色沉淀迅速变成灰绿色,最后变成红褐色 | |
| B. | 加入NaOH溶液,生成红褐色沉淀 | |
| C. | 加入硫氰化钾溶液,显示红色 | |
| D. | 加入氨水,生成红褐色沉淀 |