题目内容
5.空气污染监测仪是根据二氧化硫与溴水的定量反应来测定空气中的二氧化硫含量的.SO2+Br2+2H2O═2HBr+H2SO4
上述反应的溴来自一个装有酸性(H2SO4)溶液的电解槽阳极上的氧化反应.电解槽的阳极室与阴极室是隔开的.当测定某地区空气中SO2含量时,空气(已除尘)以1.5×10-4m3min-1的流速进入电解槽的阳极室,电流计显示电子通过的速率是8.56×10-11mols-1,此条件下能保持溴浓度恒定并恰好与SO2完全反应(空气中不含能与溴反应的其他杂质).写出上述材料中监测过程中发生的主要的化学反应方程式及该地区空气中SO2的含量(gm-3).
分析 电解溴化钾溶液生成氢氧化钾和氢气、溴单质;溴单质与二氧化硫、水反应生成硫酸和氢溴酸;
依据原子个数守恒结合原子个数守恒计算生成溴单质的物质的量,依据SO2+Br2+2H2O=H2SO4+2HBr计算二氧化硫的物质的量,据此解答.
解答 解:电解溴化钾溶液生成氢氧化钾和氢气、溴单质,化学方程式:2KBr+2H2O$\frac{\underline{\;电解\;}}{\;}$2KOH+H2↑+Br2;溴单质与二氧化硫、水反应生成硫酸和氢溴酸,化学方程式:SO2+Br2+2H2O═H2SO4+2HBr;
设每分钟电解KBr溶液生成Br2的物质的量为x,
则:2Br-Br2 电子转移
1 mol 2 mol
x 8.56×10-11×60 mol
解得:x=2.568×10-9mol,
根据SO2+Br2+2H2O=H2SO4+2HBr可知SO2的物质的量为2.568×10-9mol,
所以空气中SO2的含量为:$\frac{2.568×1{0}^{-9}×64}{1.5×1{0}^{-4}}$g•m-3=1.1×10 -3gm-3,
答:主要的化学反应方程式为2KBr+2H2O$\frac{\underline{\;电解\;}}{\;}$2KOH+H2↑+Br2、SO2+Br2+2H2O═H2SO4+2HBr;该地区空气中SO2的含量为1.1×10 -3gm-3.
点评 本题考查了化学方程式的书写与计算,题目难度中等,明确实验目的及实验原理为解答关键,注意熟练掌握化学方程式的书写原则,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
11.表中是食用碘盐包装上的部分说明,下列说法正确的是( )
| 配料 | 精盐、碘酸钾(KIO3)、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储存方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
| A. | 高温会导致碘的损失 | B. | 碘酸钾可氧化氯化钠 | ||
| C. | 可用淀粉检验碘盐中的碘酸钾 | D. | 该碘盐中碘含量是指碘酸钾的含量 |
8.用接触法制5t98%的浓硫酸,在理论上需要FeS270%(杂质不含碳元素)的硫铁矿为( )
| A. | 86t | B. | 8.6t | C. | 4.3t | D. | 43t |
17.50mL 1mol/L氯化铝溶液中c(Cl-)相等的是( )
| A. | 150ml 1mol/L氯化钠溶液 | B. | 150ml 3mol/L氯化钾溶液 | ||
| C. | 75ml 2mol/L氯化铵溶液 | D. | 50ml 1mol/L氯化钡溶液 |
15.下列溶液的溶质都是强电解质,这些溶液中的Cl?浓度与50mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150mL 1mol•L-1NaCl溶液 | B. | 75mL 1mol•L-1 CaCl2溶液 | ||
| C. | 150mL 1mol•L-1 KCl溶液 | D. | 75mL 1mol•L-1 AlCl3溶液 |
 在实验室里,第一位同学取一小块金属钠做与水反应的实验.试完成下列问题:
在实验室里,第一位同学取一小块金属钠做与水反应的实验.试完成下列问题: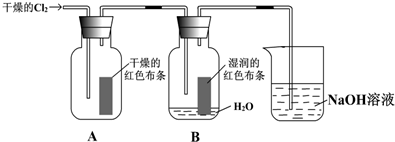
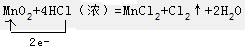
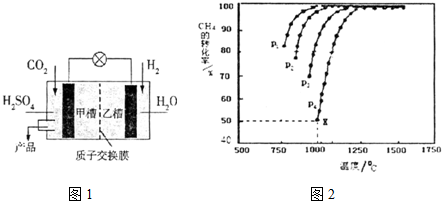 第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.
第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.