题目内容
12.下列说法正确的是( )| A. | 制取水泥和玻璃的原料中均有纯碱 | |
| B. | 普通玻璃是电的绝缘体,这种透明的固体物质是混合物,无固定的熔点 | |
| C. | 普通玻璃俗称水玻璃 | |
| D. | 硅酸盐工业使用的每一种原料都含有硅 |
分析 A、制取水泥的主要原料为黏土、石灰石、石膏等,制备普通玻璃的主要原料为纯碱、石灰石、石英等,
B、根据普通玻璃不导电以及普通玻璃的组成成分是Na2SiO3、CaSiO3、SiO2;
C、水玻璃为硅酸钠溶液,而普通玻璃的组成成分是Na2SiO3、CaSiO3、SiO2;
D、硅酸盐工业中,制玻璃的原料中使用了纯碱、碳酸钙.
解答 解:A、制取水泥和玻璃的原料中均有石灰石,故A错误;
B、普通玻璃不导电,普通玻璃的组成成分是Na2SiO3、CaSiO3、SiO2,为混合物,没有固定的熔点,故B正确;
C、水玻璃为硅酸钠溶液,而普通玻璃的组成成分是Na2SiO3、CaSiO3、SiO2,故C错误;
D.硅酸盐工业中,制玻璃的原料中使用了纯碱、碳酸钙,不含硅元素,故D错误;
故选:B.
点评 本题主要考查了硅酸盐材料的制备及用途,熟悉硅酸盐材料的定义、玻璃、水泥的制备过程是解题关键,题目难度不大.

练习册系列答案
相关题目
2.下面是溶解性表中的部分内容(室温下测定):
下列有关说法中正确的是( )
| 阳离子 | 阴离子 | ||
| OH- | SO42- | SO32- | |
| Ca2+ | ① | 微 | 不 |
| Fe3+ | 不 | 溶 | ② |
| Cu2+ | 不 | ③ | 不 |
| A. | ①处物质属于可溶性碱 | |
| B. | ②处物质组成为Fe2(SO3)3 | |
| C. | ③处物质为硫酸盐或者铜盐 | |
| D. | ①、③处物质在溶液中发生的反应一定是Cu2++2OH-═Cu(OH)2↓ |
3.已知反应mX(g)+nY(g)?qZ(g)+pW(s)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法一定正确的是( )
| A. | 通入氦气使密闭容器中压强增大,平衡向正反应方向移动 | |
| B. | 增加X的物质的量,混合气体的密度减小 | |
| C. | X的正反应速率是Y的逆反应速率的$\frac{m}{n}$倍 | |
| D. | 降低温度,混合气体的平均相对分子质量增大 |
20.有关溶度积Ksp的说法正确的是( )
| A. | Ksp的数值只与温度有关 | |
| B. | Ksp的数值只与难溶电解质的性质和温度有关 | |
| C. | Ksp的大小与沉淀量有多少和溶液中离子浓度的大小有关 | |
| D. | Ksp的数值越大,电解质在水中的溶解能力越强 |
7.Al65Cu23Fe12是一种具有凸多面体规则外形的固态物质,它具有合金的某些优良性能.有关该物质的说法中不正确的是( )
| A. | Al65Cu23Fe12的硬度比金属Al、Cu、Fe的硬度大 | |
| B. | Al65Cu23Fe12中三种金属的化合价均可视作零 | |
| C. | Al65Cu23Fe12不可用作长期浸泡在海水中的材料 | |
| D. | 1mol Al65Cu23Fe12溶于过量的硝酸时共失去265 mol电子 |
4.下列实验操作中正确的是( )
| A. | 用规格为10mL的量筒量取6.20mL的液体 | |
| B. | 称量氢氧化钠固体的质量时,将称量物放在滤纸上,并置于托盘天平的左盘,砝码放在托盘天平的右盘 | |
| C. | 利用蒸馏可除去液态混合物中沸点不同的易挥发、难挥发或不挥发的杂质 | |
| D. | 用四氯化碳萃取碘水中的碘,充分静置后紫红色液体在上层 |
1.工业上用某矿渣(主要成分是Cu2O,少量杂质是Al2O3、Fe2O3和SiO2)提取铜的操作流程如下:
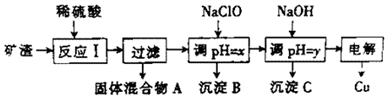
已知:①Cu2O+2H+═Cu+Cu2++H2O ②某些金属氢氧化物开始测沉淀和完全沉淀时的pH
(1)反应I中,与铁元素有关反应的离子方程式为Fe2O3+6H+═2Fe3++3H2O、2Fe3++Cu═2Fe2++Cu2+.
(2)y的数值范围是5.2≤pH<5.4.
(3)以上步骤中的NaOH可以用AC代替(填字母)
A.CuO B.NH4Cl C.Cu(OH)2
(4)电解过程中,阳极产物可能为Cl2、O2.
(5)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO.

已知:①Cu2O+2H+═Cu+Cu2++H2O ②某些金属氢氧化物开始测沉淀和完全沉淀时的pH
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 2.2 | 5.8 |
| 沉淀完成pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)y的数值范围是5.2≤pH<5.4.
(3)以上步骤中的NaOH可以用AC代替(填字母)
A.CuO B.NH4Cl C.Cu(OH)2
(4)电解过程中,阳极产物可能为Cl2、O2.
(5)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO.
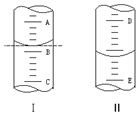 ①如图Ⅰ表示10mL量筒中液面的位置.A与B,B与C刻度间相差1mL,如果刻度A为6,量筒中液体的体积是5.2 mL.
①如图Ⅰ表示10mL量筒中液面的位置.A与B,B与C刻度间相差1mL,如果刻度A为6,量筒中液体的体积是5.2 mL.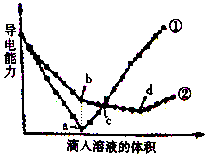 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴人溶液体积变化的曲线如图所示.
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴人溶液体积变化的曲线如图所示.