题目内容
13.(1)下列材料中属于复合材料的是D(填字母).A.硬币 B.聚氯乙烯塑料 C.氮化硅陶瓷 D.钢筋混凝土
(2)一般情况下,合金比组成它的成分金属熔点低(填“高”或“低”).
(3)钢铁在潮湿的环境中更容易被腐蚀,主要原因是钢铁里的铁和碳构成许多微小的原电池,从而加快了钢铁腐蚀.为防止腐蚀,通常在海水中行驶的轮船船身上装有一定数量的锌(填“锌”或“铜”)块来防止钢铁的腐蚀.
分析 (1)复合材料是指将两种或两种以上的材料复合成一体而形成的材料;复合材料集中了组成材料的优点,据此解答.
(2)与组成合金的纯金属相比,合金的优点一般有强度好、熔点低、抗腐蚀性更好等;
(3)根据铁和碳构成许多微小的原电池进行解答;金属活泼性Zn>Fe>Cu,活泼金属作负极,Fe作正极时可防止轮船的船体在海水中腐蚀.
解答 解:(1)A.硬币属于合金,是金属材料,故A不选;
B.聚氯乙烯塑料是有机高分子材料,故B不选;
C.氮化硅陶瓷属于新型无机非金属材料,故C不选;
D.钢筋混凝土由钢筋和混凝土组成的一种常用的复合材料,故D选;
故选:D.
(2)多数合金硬度大于组成它的成分金属,熔点低于组成它的成分金属的熔点;
故答案为:低;
(3)钢铁的电化学腐蚀是钢铁里的铁和碳构成许多微小原电池导致的腐蚀,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+;金属活泼性Zn>Fe>Cu,活泼金属作负极,Fe作正极时可防止轮船的船体在海水中腐蚀,则防止轮船的船体在海水中腐蚀,一般在轮船的船身上装有一定数量的锌块;
故答案为:原电池;锌.
点评 本题考查化学与生活,侧重基础知识的考查,需要平时积累与生活有关的化学知识,题目难度不大.

练习册系列答案
相关题目
18.下列物质中,既含共价键,又含离子键的是( )
| A. | CaCl2 | B. | Na2O2 | C. | MgO | D. | C2H4 |
4.下列微粒半径之比大于1的是( )
| A. | $\frac{r({K}^{+})}{r(K)}$ | B. | $\frac{r(Mg)}{r(Ca)}$ | C. | $\frac{r(Cl)}{r(C{l}^{-})}$ | D. | $\frac{r({S}^{2-})}{r({K}^{+})}$ |
1.将纯锌片和纯铜片按图所示插入相同浓度的稀硫酸中,以下有关叙述正确的是( )

| A. | 甲装置中电能转化为化学能 | B. | 乙装置中电能转化为化学能 | ||
| C. | 乙装置中铜片表面有气泡生成 | D. | 甲装置中铜片表面有气泡产生 |
8.下列化学用语表达不正确的是( )
| A. | F-离子结构示意图: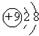 | |
| B. | 氯化钠的电子式: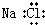 | |
| C. | 二氧化碳的结构式:O=C=O | |
| D. | 碳酸氢钠的电离方程式:NaHCO3=Na++HCO3- |
18.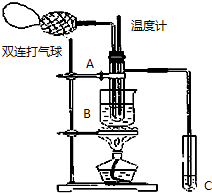 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH(注明反应条件).
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中,目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A的支管口处,目的是收集含乙酸的馏分.
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C,烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末;实验仪器任选.该方案为方法一:将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸;
方法二:把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成.
 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH(注明反应条件).
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中,目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A的支管口处,目的是收集含乙酸的馏分.
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C,烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末;实验仪器任选.该方案为方法一:将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸;
方法二:把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成.
2.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 在标准状况下,11.2L NO与11.2L O2混合后所含分子数为0.75 NA | |
| B. | 7.8 g Na2O2与足量的CO2反应时失去的电子数为0.2 NA | |
| C. | 1L 1mol/L的醋酸溶液中所含离子总数为2NA | |
| D. | 常温常压下,16g O3所含的原子数为NA |