题目内容
8.下列化学用语表达不正确的是( )| A. | F-离子结构示意图: | |
| B. | 氯化钠的电子式: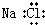 | |
| C. | 二氧化碳的结构式:O=C=O | |
| D. | 碳酸氢钠的电离方程式:NaHCO3=Na++HCO3- |
分析 A.F-核外有10个电子;
B.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
C.二氧化碳分子中含有两个碳氧双键;
D.碳酸氢钠为强电解质,完全电离,注意碳酸氢根离子为弱酸的酸式根离子不能拆.
解答 解:A.F-核外有10个电子,结构示意图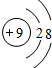 ,故A正确;
,故A正确;
B.氯化钠为离子化合物,钠离子用离子符号表示,氯离子需要标出最外层电子及所带电荷,电子式为: ,故B错误;
,故B错误;
C.二氧化碳的电子式为: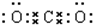 ,则二氧化碳的结构式为:O=C=O,故C正确;
,则二氧化碳的结构式为:O=C=O,故C正确;
D.碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3-,故D正确;
故选B.
点评 本题考查核素以及化学用语等,掌握电子式、结构式、结构示意图以及电离方程式是解题的关键,题目难度不大.

练习册系列答案
相关题目
13.为了使K2S溶液中$\frac{{K}^{+}}{{S}^{2-}}$的比值变小,可加入的物质是( )
①适量的HCl;②适量的NaOH;③适量的KOH;④适量的NaHS.
①适量的HCl;②适量的NaOH;③适量的KOH;④适量的NaHS.
| A. | ②③ | B. | ①② | C. | ③④ | D. | ②④ |
16. 在弱电解质溶液中存在电离平衡,试回答下列问题.
在弱电解质溶液中存在电离平衡,试回答下列问题.
(1)氨水是中学常见的弱碱
①常温下,下列事实不能证明氨水是弱碱的是A(填字母序号).
A.氨水能跟稀盐酸反应生成氯化铵
B. PH=11的氨水稀释10倍后,溶液的PH>10
C.0.1mol•L-1氨水pH为11
D.0.1mol•L-1氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是BC(填字母序号).
A.通入氨气 B.加入少量氯化铝固体 C.加水稀释 D.加入少量氯化铵固体
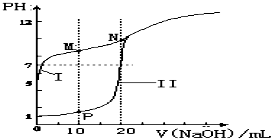
(2)用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:
①N点pH>7的原因是(用离子方程式表示)X-+H2O?HX+OH-.
②下列说法不正确的是b(填字母).
a.M点c(Na+)>c(X-) b.M点c(HX)<c(X-)
c.M点 c(HX)+c(X-)=2c(Na+)d.N点c(H+)+c(HX)=c(OH-)
(3)若将pH=11、等体积的NaOH溶液和NH3•H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH=9,则m<n(填“<”“>”或“=”).
(4)常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
以下离子浓度关系的判断正确的是AD
A.NaHSO3溶液中c(HSO3-)>c(H+)>c(SO32-)>c(H2SO3)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)=c(HSO3-)+2c(SO32-)
 在弱电解质溶液中存在电离平衡,试回答下列问题.
在弱电解质溶液中存在电离平衡,试回答下列问题.(1)氨水是中学常见的弱碱
①常温下,下列事实不能证明氨水是弱碱的是A(填字母序号).
A.氨水能跟稀盐酸反应生成氯化铵
B. PH=11的氨水稀释10倍后,溶液的PH>10
C.0.1mol•L-1氨水pH为11
D.0.1mol•L-1氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是BC(填字母序号).
A.通入氨气 B.加入少量氯化铝固体 C.加水稀释 D.加入少量氯化铵固体
(2)用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:
①N点pH>7的原因是(用离子方程式表示)X-+H2O?HX+OH-.
②下列说法不正确的是b(填字母).
a.M点c(Na+)>c(X-) b.M点c(HX)<c(X-)
c.M点 c(HX)+c(X-)=2c(Na+)d.N点c(H+)+c(HX)=c(OH-)
(3)若将pH=11、等体积的NaOH溶液和NH3•H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH=9,则m<n(填“<”“>”或“=”).
(4)常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
| n(SO32-):n(HSO3-) | 91:1 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
A.NaHSO3溶液中c(HSO3-)>c(H+)>c(SO32-)>c(H2SO3)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)=c(HSO3-)+2c(SO32-)
18.下列物质中,不与水发生反应的是( )
| A. | CaO | B. | SiO2 | C. | CO2 | D. | SO2 |
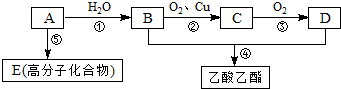
 .
. 是一种抗氧化药物,存在如图所示的转化关系.
是一种抗氧化药物,存在如图所示的转化关系.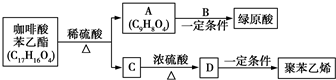
 .
.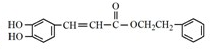 .
. (任写1个).
(任写1个).