题目内容
1.将纯锌片和纯铜片按图所示插入相同浓度的稀硫酸中,以下有关叙述正确的是( )
| A. | 甲装置中电能转化为化学能 | B. | 乙装置中电能转化为化学能 | ||
| C. | 乙装置中铜片表面有气泡生成 | D. | 甲装置中铜片表面有气泡产生 |
分析 原电池的构成条件:
1、有两种活泼性不同的金属(或其中一种为非金属导体)作电极;
2、电极均需插入电解质溶液中;
3、两极相互连接(或接触);
4、能自发地发生氧化还原反应;
甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.
解答 解:根据原电池的构成条件判断,甲是原电池,乙不能形成原电池.
A.甲是原电池,所以甲是把化学能转变为电能的装置,故A错误;
B.乙不是原电池,不是把化学能转变为电能的装置,应是化学能转化为热能,故B错误;
C.乙中锌片可以和硫酸反应产生氢气,金属铜和硫酸不反应,铜片表面无气泡生成,故C错误;
D.甲中铜片是正极,该极上氢离子得电子析出氢气,故D正确;
故选D.
点评 本题考查了置换反应和原电池的有关知识,题目难度不大,注意把握原电池的组成条件和工作原理.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.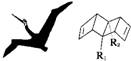 始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )
始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )
 始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )
始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )| A. | 始祖鸟烯与CH2═CH-CH═CH2互为同系物 | |
| B. | 若R1、R2为-CH3,则其化学式为C12H16 | |
| C. | 若R1═R2,一定条件下烯烃双键碳原子上的氢也能取代,则始祖鸟烯环上的二氯代物有10种 | |
| D. | 始祖鸟烯既能使酸性高锰酸钾褪色也能使溴水褪色,其褪色原理是一样的 |
12.表为元素周期表的一部分.
回答下列问题
(1)Z元素在周期表中的位置为第三周期第ⅦA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)已知碳元素形成的物质种类最多,某烷烃A在同温同压下蒸气的密度是H2的36倍,A的分子式为C5H12.烷烃B的分子中含有200个氢原子,B的分子式为C99H200.
(5)碳与镁形成的1mol化合物Mg2C3与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的分子式为C3H4其与水反应的化学方程式为Mg2C3+4H2O═2Mg(OH)2+C3H4↑.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期第ⅦA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)已知碳元素形成的物质种类最多,某烷烃A在同温同压下蒸气的密度是H2的36倍,A的分子式为C5H12.烷烃B的分子中含有200个氢原子,B的分子式为C99H200.
(5)碳与镁形成的1mol化合物Mg2C3与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的分子式为C3H4其与水反应的化学方程式为Mg2C3+4H2O═2Mg(OH)2+C3H4↑.
9.用胆矾配制0.1mol/L硫酸铜溶液1L,应当( )
| A. | 取25.0gCuSO4•5H2O溶于1L水中 | |
| B. | 取16.0gCuSO4•5H2O溶于水,再稀释至1L | |
| C. | 将胆矾加热失去结晶水,再取无水硫酸铜16.0g溶于1L水 | |
| D. | 取25.0gCuSO4•5H2O溶于水,再稀释配成1L溶液 |
16. 在弱电解质溶液中存在电离平衡,试回答下列问题.
在弱电解质溶液中存在电离平衡,试回答下列问题.
(1)氨水是中学常见的弱碱
①常温下,下列事实不能证明氨水是弱碱的是A(填字母序号).
A.氨水能跟稀盐酸反应生成氯化铵
B. PH=11的氨水稀释10倍后,溶液的PH>10
C.0.1mol•L-1氨水pH为11
D.0.1mol•L-1氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是BC(填字母序号).
A.通入氨气 B.加入少量氯化铝固体 C.加水稀释 D.加入少量氯化铵固体
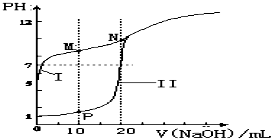
(2)用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:
①N点pH>7的原因是(用离子方程式表示)X-+H2O?HX+OH-.
②下列说法不正确的是b(填字母).
a.M点c(Na+)>c(X-) b.M点c(HX)<c(X-)
c.M点 c(HX)+c(X-)=2c(Na+)d.N点c(H+)+c(HX)=c(OH-)
(3)若将pH=11、等体积的NaOH溶液和NH3•H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH=9,则m<n(填“<”“>”或“=”).
(4)常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
以下离子浓度关系的判断正确的是AD
A.NaHSO3溶液中c(HSO3-)>c(H+)>c(SO32-)>c(H2SO3)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)=c(HSO3-)+2c(SO32-)
 在弱电解质溶液中存在电离平衡,试回答下列问题.
在弱电解质溶液中存在电离平衡,试回答下列问题.(1)氨水是中学常见的弱碱
①常温下,下列事实不能证明氨水是弱碱的是A(填字母序号).
A.氨水能跟稀盐酸反应生成氯化铵
B. PH=11的氨水稀释10倍后,溶液的PH>10
C.0.1mol•L-1氨水pH为11
D.0.1mol•L-1氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是BC(填字母序号).
A.通入氨气 B.加入少量氯化铝固体 C.加水稀释 D.加入少量氯化铵固体
(2)用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:
①N点pH>7的原因是(用离子方程式表示)X-+H2O?HX+OH-.
②下列说法不正确的是b(填字母).
a.M点c(Na+)>c(X-) b.M点c(HX)<c(X-)
c.M点 c(HX)+c(X-)=2c(Na+)d.N点c(H+)+c(HX)=c(OH-)
(3)若将pH=11、等体积的NaOH溶液和NH3•H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH=9,则m<n(填“<”“>”或“=”).
(4)常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
| n(SO32-):n(HSO3-) | 91:1 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
A.NaHSO3溶液中c(HSO3-)>c(H+)>c(SO32-)>c(H2SO3)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)=c(HSO3-)+2c(SO32-)
6.下列物质中,既可用浓H2SO4干燥,又可用碱石灰干燥的是( )
| A. | Cl2 | B. | O2 | C. | SO2 | D. | NH3 |
11.下列物质中,能用铝制容器贮运的是( )
| A. | 冷的稀盐酸 | B. | 冷的浓硫酸 | C. | 冷的稀硫酸 | D. | 冷的稀醋酸 |
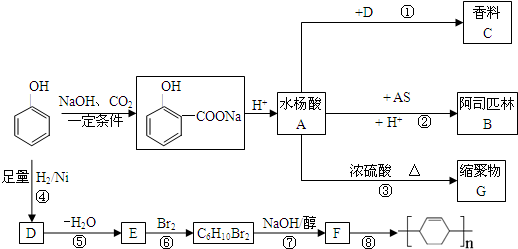
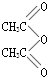 ,
, .
.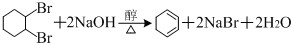 .
.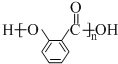 .
.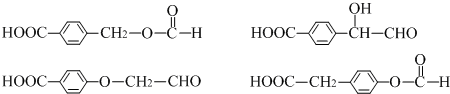 .
.