题目内容
4.下列微粒半径之比大于1的是( )| A. | $\frac{r({K}^{+})}{r(K)}$ | B. | $\frac{r(Mg)}{r(Ca)}$ | C. | $\frac{r(Cl)}{r(C{l}^{-})}$ | D. | $\frac{r({S}^{2-})}{r({K}^{+})}$ |
分析 电子层数越多,半径越大;
当电子层数相同时,核电荷数越大,半径越小;
当电子层数相同、核电荷数也相同时,核外的电子数越多,半径越大,据此分析.
解答 解:电子层数越多,半径越大;
当电子层数相同时,核电荷数越大,半径越小;
当电子层数相同、核电荷数也相同时,核外的电子数越多,半径越大.
A、K原子核外有4个电子层,而K+有三个电子层,故r(K)>r(K+),则$\frac{r({K}^{+})}{r(K)}$小于1,故A错误;
B、Mg的核外有3个电子层,Ca的核外有4个电子层,故r(Mg)<r(Ca),则此比值小于1,故B错误;
C、Cl和Cl-的核外均有3个电子层,核电荷数均为17个,但Cl-的核外电子数多于Cl,故r(Cl)<r(Cl-),则比值小于1,故C错误;
D、S2-和K+的核外均有3个电子层,但K+的核电荷数更大,故半径更小,则r(S2-)>r(K+),则比值大于1,故D正确.
故选D.
点评 本题考查了微粒半径的大小比较,应注意的是考虑的顺序是电子层数、核电荷数和电子数,难度不大.

练习册系列答案
相关题目
9.某温度时,浓度都是1mol/L的两种气体X2、Y2在密闭容器中反应生成气体Z达平衡后,c (X2)为0.4mol/L,c (Y2)为0.8mol/L,生成c (Z)为0.4mol/L,则该反应的反应式(z用x、y表示)是( )
| A. | X2+2Y2 ?2XY2 | B. | 2X2+Y2 ?2X2Y | C. | 3X2+Y2?2X3Y | D. | X2+3Y2?2XY3 |
10.下列变化中需加氧化剂的是( )
| A. | Fe2O3→Fe | B. | CuO→Cu | C. | CO${\;}_{3}^{2-}$→CO2 | D. | Br-→Br2 |
12.表为元素周期表的一部分.
回答下列问题
(1)Z元素在周期表中的位置为第三周期第ⅦA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)已知碳元素形成的物质种类最多,某烷烃A在同温同压下蒸气的密度是H2的36倍,A的分子式为C5H12.烷烃B的分子中含有200个氢原子,B的分子式为C99H200.
(5)碳与镁形成的1mol化合物Mg2C3与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的分子式为C3H4其与水反应的化学方程式为Mg2C3+4H2O═2Mg(OH)2+C3H4↑.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期第ⅦA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)已知碳元素形成的物质种类最多,某烷烃A在同温同压下蒸气的密度是H2的36倍,A的分子式为C5H12.烷烃B的分子中含有200个氢原子,B的分子式为C99H200.
(5)碳与镁形成的1mol化合物Mg2C3与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的分子式为C3H4其与水反应的化学方程式为Mg2C3+4H2O═2Mg(OH)2+C3H4↑.
9.用胆矾配制0.1mol/L硫酸铜溶液1L,应当( )
| A. | 取25.0gCuSO4•5H2O溶于1L水中 | |
| B. | 取16.0gCuSO4•5H2O溶于水,再稀释至1L | |
| C. | 将胆矾加热失去结晶水,再取无水硫酸铜16.0g溶于1L水 | |
| D. | 取25.0gCuSO4•5H2O溶于水,再稀释配成1L溶液 |
16. 在弱电解质溶液中存在电离平衡,试回答下列问题.
在弱电解质溶液中存在电离平衡,试回答下列问题.
(1)氨水是中学常见的弱碱
①常温下,下列事实不能证明氨水是弱碱的是A(填字母序号).
A.氨水能跟稀盐酸反应生成氯化铵
B. PH=11的氨水稀释10倍后,溶液的PH>10
C.0.1mol•L-1氨水pH为11
D.0.1mol•L-1氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是BC(填字母序号).
A.通入氨气 B.加入少量氯化铝固体 C.加水稀释 D.加入少量氯化铵固体
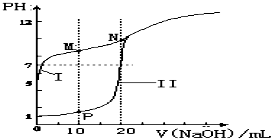
(2)用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:
①N点pH>7的原因是(用离子方程式表示)X-+H2O?HX+OH-.
②下列说法不正确的是b(填字母).
a.M点c(Na+)>c(X-) b.M点c(HX)<c(X-)
c.M点 c(HX)+c(X-)=2c(Na+)d.N点c(H+)+c(HX)=c(OH-)
(3)若将pH=11、等体积的NaOH溶液和NH3•H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH=9,则m<n(填“<”“>”或“=”).
(4)常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
以下离子浓度关系的判断正确的是AD
A.NaHSO3溶液中c(HSO3-)>c(H+)>c(SO32-)>c(H2SO3)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)=c(HSO3-)+2c(SO32-)
 在弱电解质溶液中存在电离平衡,试回答下列问题.
在弱电解质溶液中存在电离平衡,试回答下列问题.(1)氨水是中学常见的弱碱
①常温下,下列事实不能证明氨水是弱碱的是A(填字母序号).
A.氨水能跟稀盐酸反应生成氯化铵
B. PH=11的氨水稀释10倍后,溶液的PH>10
C.0.1mol•L-1氨水pH为11
D.0.1mol•L-1氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是BC(填字母序号).
A.通入氨气 B.加入少量氯化铝固体 C.加水稀释 D.加入少量氯化铵固体
(2)用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:
①N点pH>7的原因是(用离子方程式表示)X-+H2O?HX+OH-.
②下列说法不正确的是b(填字母).
a.M点c(Na+)>c(X-) b.M点c(HX)<c(X-)
c.M点 c(HX)+c(X-)=2c(Na+)d.N点c(H+)+c(HX)=c(OH-)
(3)若将pH=11、等体积的NaOH溶液和NH3•H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH=9,则m<n(填“<”“>”或“=”).
(4)常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
| n(SO32-):n(HSO3-) | 91:1 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
A.NaHSO3溶液中c(HSO3-)>c(H+)>c(SO32-)>c(H2SO3)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)=c(HSO3-)+2c(SO32-)
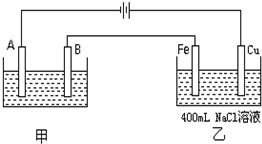 如图为相互串联的甲、乙两个电解池.试回答:
如图为相互串联的甲、乙两个电解池.试回答: