题目内容
2.设NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 在标准状况下,11.2L NO与11.2L O2混合后所含分子数为0.75 NA | |
| B. | 7.8 g Na2O2与足量的CO2反应时失去的电子数为0.2 NA | |
| C. | 1L 1mol/L的醋酸溶液中所含离子总数为2NA | |
| D. | 常温常压下,16g O3所含的原子数为NA |
分析 A、NO2气体中存在平衡:2NO2?N2O4;
B、求出过氧化钠的物质的量,然后根据1mol过氧化钠反应转移1mol电子来分析;
C、醋酸是弱电解质,不能完全电离;
D、臭氧由氧原子构成.
解答 解:A、标况下11.2LNO即0.5molNO和11.2L氧气即0.5mol氧气反应后生成0.5molNO2,并剩余0.25mol氧气,即所得气体为0.75mol,但NO2气体中存在平衡:2NO2?N2O4,导致分子个数减小,故分子数小于0.75NA个,故A错误;
B、7.8g过氧化钠的物质的量为0.1mol,而1mol过氧化钠反应转移1mol电子,故0.1mol过氧化钠转移0.1NA个电子,故B错误;
C、醋酸是弱电解质,不能完全电离,故溶液中的离子小于2NA个,故C错误;
D、臭氧由氧原子构成,故16g臭氧中含有的氧原子的物质的量n=$\frac{16g}{16g/mol}$=1mol,故为NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
12.表为元素周期表的一部分.
回答下列问题
(1)Z元素在周期表中的位置为第三周期第ⅦA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)已知碳元素形成的物质种类最多,某烷烃A在同温同压下蒸气的密度是H2的36倍,A的分子式为C5H12.烷烃B的分子中含有200个氢原子,B的分子式为C99H200.
(5)碳与镁形成的1mol化合物Mg2C3与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的分子式为C3H4其与水反应的化学方程式为Mg2C3+4H2O═2Mg(OH)2+C3H4↑.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期第ⅦA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)已知碳元素形成的物质种类最多,某烷烃A在同温同压下蒸气的密度是H2的36倍,A的分子式为C5H12.烷烃B的分子中含有200个氢原子,B的分子式为C99H200.
(5)碳与镁形成的1mol化合物Mg2C3与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的分子式为C3H4其与水反应的化学方程式为Mg2C3+4H2O═2Mg(OH)2+C3H4↑.
7.下列对化学反应的认识错误的是( )
| A. | 有化学键破坏的一定是化学反应 | B. | 会产生新的物质 | ||
| C. | 可能会引起物质状态的变化 | D. | 一定伴随着能量的变化 |
11.下列物质中,能用铝制容器贮运的是( )
| A. | 冷的稀盐酸 | B. | 冷的浓硫酸 | C. | 冷的稀硫酸 | D. | 冷的稀醋酸 |
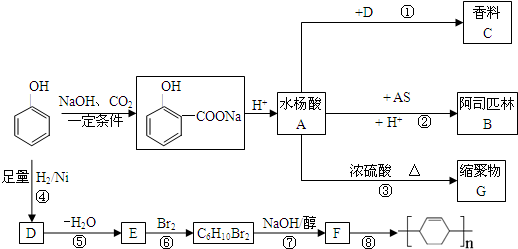
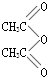 ,
, .
.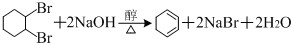 .
.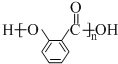 .
.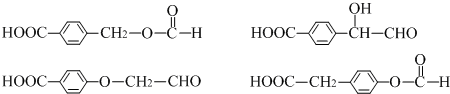 .
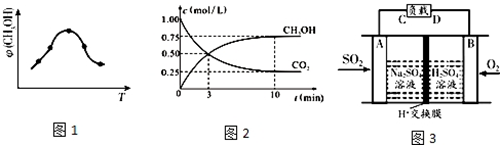
.
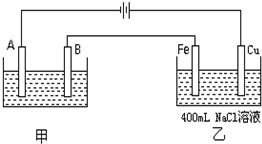 如图为相互串联的甲、乙两个电解池.试回答:
如图为相互串联的甲、乙两个电解池.试回答: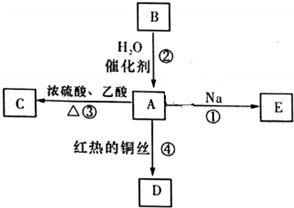 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应. .
.