题目内容
13.某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.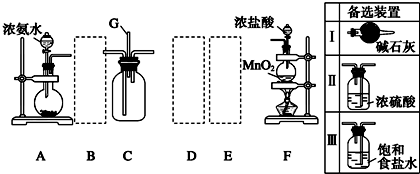
连接顺序是左边是:A→B→C 右边是(从右向左)F→E→D→C
①装置A中发生反应的化学方程式:NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
②虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:BⅠ,DⅡ,EⅢ.(均填编号)
③氯气和氨气在常温下相混就会反应,装置C内出现浓厚的白烟并在容器内壁凝结,同时还生成一种无色的气体,写出C装置中发生反应的化学方程式8NH3+3C12=6NH4C1+N2.
④从装置C的出气管口处逸出的尾气可能含有污染环境的气体,写出处理有色气体的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
分析 ①根据装置可知,A中用浓氨水与碱石灰制氨气,碱石灰吸收氨水中的水,同时放热使氨气挥发出来;
②根据杂质的性质选择除杂装置;
③氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,由此写出反应方程式;
④从装置C的出气管口处逸出的有色气体应为氯气,吸收氯气用氢氧化钠溶液,根据电荷守恒和元素守恒书写离子方程式.
解答 解:①根据装置可知,A中用浓氨水与碱石灰制氨气,碱石灰吸收氨水中的水,同时放热使氨气挥发出来,反应方程式可表示为NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
②氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,故B选Ⅰ;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和 水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢E应选Ⅲ;水蒸气常用浓硫酸除去,故D选Ⅱ.
故答案为:Ⅰ、Ⅱ、Ⅲ.
③氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气8NH3+3C12=6NH4C1+N2,
故答案为:8NH3+3C12=6NH4C1+N2;
④从装置C的出气管口处逸出的有色气体应为氯气,吸收氯气用氢氧化钠溶液,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了氯气、氨气的实验室制备及性质检验,把握实验装置的作用、物质的性质为解答的关键,题目难度中等.

练习册系列答案
相关题目
5.下列说法正确的是( )
| A. | 玻璃、水晶、陶瓷的主要成分均是硅酸盐 | |
| B. | SO2可以使溴水褪色,所以SO2具有漂白性 | |
| C. | 将浓氨水滴到氢氧化钠固体中可以制取氨气 | |
| D. | NaHCO3能与碱反应,因此食品工业上用作焙制糕点的膨松剂 |
2.在密闭容器中,一定量混合气体发生下列反应:aA(g)+bB(g)?cC(g)+dD(g),达到平衡后,测得C气体的浓度为0.5mol/L.当在恒温下,将密闭容器的体积缩小为$\frac{1}{2}$,再达平衡时,测得C气体的浓度为0.9mol/L.则下列叙述正确的是( )
| A. | 反应速率降低 | B. | 平衡向右移动 | C. | B的转化率提高 | D. | a+b<c+d |
9.某同学为了验证Fe3+是否能氧化H2SO3生成了SO42-,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,再进行以下实验:
(1)向FeCl3溶液中通入一定量的SO2,反应的离子方程式:SO2+2H20+2Fe3+=2Fe2++SO42-+4H+
(2)检验吸收液中SO42-的方法:取少量样品溶液于试管中,先滴入足量的稀盐酸,再滴入氯化钡溶液,有白色沉淀生成
(3)吸收液中除了含有H+、Cl-、SO42-以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设.
假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在Fe2+、H2SO3
假设3:溶液中存在Fe2+而不存在H2SO3 (二者恰好完全反应).
②设计方案、进行实验,验证假设.请在表中写出实验步骤以及预期现象和结论(可以不填满).限选实验试剂和仪器:试管、滴管、0.1moL•L-1KMnO4、0,.1moL•L-1KSCN溶液、品红溶液.
(1)向FeCl3溶液中通入一定量的SO2,反应的离子方程式:SO2+2H20+2Fe3+=2Fe2++SO42-+4H+
(2)检验吸收液中SO42-的方法:取少量样品溶液于试管中,先滴入足量的稀盐酸,再滴入氯化钡溶液,有白色沉淀生成
(3)吸收液中除了含有H+、Cl-、SO42-以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设.
假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在Fe2+、H2SO3
假设3:溶液中存在Fe2+而不存在H2SO3 (二者恰好完全反应).
②设计方案、进行实验,验证假设.请在表中写出实验步骤以及预期现象和结论(可以不填满).限选实验试剂和仪器:试管、滴管、0.1moL•L-1KMnO4、0,.1moL•L-1KSCN溶液、品红溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取LKSCN溶液,向试管中滴入1~2滴0.1mol/LKSCN溶液 | (1)若出现红色,则假设1成立; (2)若未出现红色,则假设2或假设3成立. |
步骤2:另取2~3mL样品溶液于试管中滴入1~2mL品红稀溶液 | 1若品红溶液红色褪色,假设2成立; 2若品红溶液不褪色,结合步骤1中的(2)则假设3成立 |
20.CuSO4是一种重要的化工原料,有关制备及性质如下所示.下列说法错误的是( )

| A. | 生成等量的CuSO4时,②消耗的酸最少,且能体现绿色化学思想 | |
| B. | 反应⑥中Y可以是葡萄糖或乙醛溶液 | |
| C. | 反应④所得混合气体X中一定有O2 | |
| D. | 反应①中H2SO4与HNO3物质的量最佳比为3:1 |
 煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择. 反应A,可实现氯的循环利用。
反应A,可实现氯的循环利用。 4mol HCl被氧化,放出115.6kJ的热量。
4mol HCl被氧化,放出115.6kJ的热量。
