题目内容
7.下列说法不正确的是( )| A. | 用10mL量筒量取6.8mL稀H2SO4 | |
| B. | 用碱式滴定管量取15.80mLKMnO4溶液 | |
| C. | 酸碱中和滴定时,滴定管需用标准液或待测液润洗 | |
| D. | 中和热测定时,氢氧化钠溶液稍过量的目的是为了保证盐酸完全被中和 |
分析 A、量筒能精确到0.1mL;
B、强氧化性溶液只能盛放到酸式滴定管中;
C、滴定管要用所盛放的溶液来润洗;
D、为了保证酸碱之间完全中和,往往需要一方过量.
解答 解:A、量筒能精确到0.1mL,故可以用10mL量筒量取6.8mL稀H2SO4,故A正确;
B、强氧化性溶液只能盛放到酸式滴定管中,盛放到碱式滴定管中会造成橡胶管的腐蚀,故B错误;
C、滴定管要用所盛放的溶液来润洗,否则所盛放的溶液会造成稀释,故C正确;
D、为了保证酸碱之间完全中和,往往需要一方过量,实验中氢氧化钠溶液稍过量是为了使盐酸完全被氢氧化钠中和,故D正确.
故选B.
点评 本题考查了滴定管的使用以及中和热的测定,中和热指的是强酸和强碱的稀溶液发生中和反应生成1mol水释放的热量,是一个定值,这是解题的关键,难度不大.

练习册系列答案
相关题目
17.我国海洋资源丰富,开发利用具有广阔前景.
(1)利用海水可制备氯气.
①制得的氯气,为便于储存,要将其液化[C12(g)?Cl2(l)],应采取的措施是降温(或加压)(只写出一种措施).
②液氯储存区贴有的说明卡如表(部分):
用离子方程式表示“泄漏处理”中NaHSO3溶液的作用.HSO3-+C12+H2O=SO42-+2C1-+3H+
若氯气泄漏后遇到苯,在钢瓶表面氯气和苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯气与苯的反应有催化作用
(2)利用海水脱硫可解决燃煤排放SO2造成的环境问题,工艺流程如图:
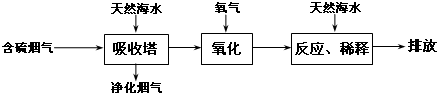
①天然海水呈碱性,写出SO2与过量海水中OH-的反应的离子方程式.SO2+2OH-=SO32-+H2O
②天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,请写出氧化过程中H2SO3被氧化的化学方程式:2H2SO3+O2=2H2SO4;氧化后的“海水”需要引入大量的天然海水与之混合才能排放,该操作的主要目的是中和经氧气氧化后海水中生成的酸【或中和酸;降低氧化后溶液的酸性】
(3)工业从海水中提溴的过程如下:
海水$\stackrel{除去悬浮杂质}{→}$$\stackrel{浓缩}{→}$$→_{氧化}^{氧化剂}$$\stackrel{热空气}{→}$Br2(g)$→_{吸收}^{Na_{2}CO_{3}溶液}$$[\begin{array}{l}{NaBr}\\{NaBr{O}_{3}}\end{array}]$$\stackrel{H_{2}SO_{4}}{→}$Br2
①通过热空气的目的是将Br2吹出
②溶液中的NaBr、NaBrO3用足量的硫酸处理后得到Br2单质,每生成1mol Br2转移电子的物质的量是1.67mol.
(1)利用海水可制备氯气.
①制得的氯气,为便于储存,要将其液化[C12(g)?Cl2(l)],应采取的措施是降温(或加压)(只写出一种措施).
②液氯储存区贴有的说明卡如表(部分):
| 危险性 | 危险品 |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质,设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
若氯气泄漏后遇到苯,在钢瓶表面氯气和苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯气与苯的反应有催化作用
(2)利用海水脱硫可解决燃煤排放SO2造成的环境问题,工艺流程如图:

①天然海水呈碱性,写出SO2与过量海水中OH-的反应的离子方程式.SO2+2OH-=SO32-+H2O
②天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,请写出氧化过程中H2SO3被氧化的化学方程式:2H2SO3+O2=2H2SO4;氧化后的“海水”需要引入大量的天然海水与之混合才能排放,该操作的主要目的是中和经氧气氧化后海水中生成的酸【或中和酸;降低氧化后溶液的酸性】
(3)工业从海水中提溴的过程如下:
海水$\stackrel{除去悬浮杂质}{→}$$\stackrel{浓缩}{→}$$→_{氧化}^{氧化剂}$$\stackrel{热空气}{→}$Br2(g)$→_{吸收}^{Na_{2}CO_{3}溶液}$$[\begin{array}{l}{NaBr}\\{NaBr{O}_{3}}\end{array}]$$\stackrel{H_{2}SO_{4}}{→}$Br2
①通过热空气的目的是将Br2吹出
②溶液中的NaBr、NaBrO3用足量的硫酸处理后得到Br2单质,每生成1mol Br2转移电子的物质的量是1.67mol.
18.2015年10月,屠呦呦因发现青蒿素和双氢青蒿素治疗疟疾的新疗法而获得诺贝尔生理学或医学奖.双氢青蒿素的化学式为C15H24O5,相对分子质量为284.下面关于双氢青蒿素的说法正确的是( )
| A. | 1mol双氢青蒿素的质量为284g?mol-1 | |
| B. | 双氢青蒿素的摩尔质量等于它的相对分子质量 | |
| C. | 14.2g双氢青蒿素中含有的原子总数为2.2NA | |
| D. | 含有6.02×1023个碳原子的双氢青蒿素的物质的量为1mol |
15.下列试剂,既能与Na2CO3溶液反应,又能与NaHCO3的是( )
| A. | CaCl2溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | Ba(OH)2溶液 |
12.如表各组溶液电解一段时间后,再加入相关物质,溶液能恢复原来组成的是( )
| 电解质溶液 | 阳极 | 阴极 | 加入的物质 | |
| A | NaCl溶液 | 碳 | 铁 | 盐酸 |
| B | 稀硫酸 | 铜 | 碳 | 水 |
| C | 硫酸铜溶液 | 铜 | 碳 | 硫酸铜 |
| D | NaOH溶液 | 碳 | 铁 | 水 |
| A. | A | B. | B | C. | C | D. | D |
16.下列有关电解应用,正确的是( )
| A. | 电解精炼铜时,粗铜作阴极 | |
| B. | 电解精炼铜时,溶液浓度基本不变 | |
| C. | 在铁制容器上镀铜时,可用CuSO4溶液作电镀液 | |
| D. | 在铁制容器上镀铜时,铁制容器连接外接电源的正极 |
17.用NA表示阿伏伽德罗常数的值,下列判断正确的是( )
| A. | 18H2O含有的氢原子数目为NA | |
| B. | 1molFe与足量盐酸反应失去的电子数为3NA | |
| C. | 标准状况下,22.4L等物质的量的CO2和O2混合气体中含有氧原子数为2NA | |
| D. | 2mol•L-1NaCl溶液中含有Na+个数为2NA |
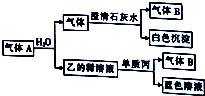 将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在如图转化关系,试回答下列问题:
将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在如图转化关系,试回答下列问题: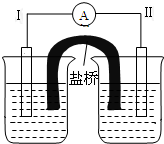 根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示.
根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示.