题目内容
17.用NA表示阿伏伽德罗常数的值,下列判断正确的是( )| A. | 18H2O含有的氢原子数目为NA | |
| B. | 1molFe与足量盐酸反应失去的电子数为3NA | |
| C. | 标准状况下,22.4L等物质的量的CO2和O2混合气体中含有氧原子数为2NA | |
| D. | 2mol•L-1NaCl溶液中含有Na+个数为2NA |
分析 A、求出水的物质的量,然后根据水中含2个氢原子来分析;
B、铁与盐酸反应后变为+2价;
C、求出混合气体的物质的量,然后根据二氧化碳和氧气中含2个氧原子来分析;
D、溶液体积不明确.
解答 解:A、18g水的物质的量为1mol,而水中含2个氢原子,故1mol水中含2mol氢原子即2NA个,故A错误;
B、铁与盐酸反应后变为+2价,故1mol铁失去2mol电子即2NA个,故B错误;
C、标况下22.4L二氧化碳和氧气的混合气体的物质的量为1mol,而二氧化碳和氧气中含2个氧原子,故1mol混合物中含2mol氧原子即2NA个,故C正确;
D、溶液体积不明确,故溶液中的钠离子的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
7.下列说法不正确的是( )
| A. | 用10mL量筒量取6.8mL稀H2SO4 | |
| B. | 用碱式滴定管量取15.80mLKMnO4溶液 | |
| C. | 酸碱中和滴定时,滴定管需用标准液或待测液润洗 | |
| D. | 中和热测定时,氢氧化钠溶液稍过量的目的是为了保证盐酸完全被中和 |
12.下列表示对应化学反应的离子方程式正确的是( )
| A. | 钠和水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 碳酸钙与盐酸反应:CO32-+2Fe3+═Cu2++2Fe2+ | |
| C. | 铜片和氯化铁溶液反应:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
9.将铁屑溶于过量的稀盐酸后,再加入下列物质,会有Fe3+生成的是( )
| A. | 溴水 | B. | 硫酸锌 | C. | 硝酸钠 | D. | 氯化铜 |
6.下列根据实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向Fe(NO3)2样品溶于稀H2SO4 | 溶液不变红 | 稀硫酸不能氧化Fe2+ |
| C | 将SO2通入Ba(N03)2溶液中 | 无明显现象 | SO2与Ba(NO3)2不反应 |
| D | 葡萄糖溶液与新制Cu(OH)2混合加热 | 生成砖红色沉淀 | 葡萄糖分子中含有醛基 |
| A. | A | B. | B | C. | C | D. | D |
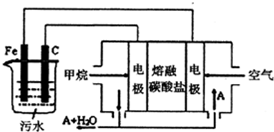 电浮选凝聚法是工业上采用的一种污水处理方法,通过电解污水最终生成的Fe(OH)3吸附污物而沉积下来,达到净水的目的.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用,某科研小组利用上述原理,设计出如图所示的装置.
电浮选凝聚法是工业上采用的一种污水处理方法,通过电解污水最终生成的Fe(OH)3吸附污物而沉积下来,达到净水的目的.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用,某科研小组利用上述原理,设计出如图所示的装置.
 合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用.