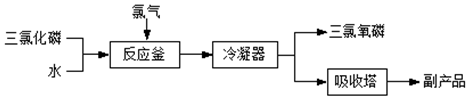
题目内容
5.下列叙述中,正确的是( )| A. | 无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分NaClO | |
| B. | 钢铁腐蚀的负极反应为:Fe-3e-=Fe3+ | |
| C. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| D. | H2-O2燃料电池中电解液为H2SO4,则正极反应式为:O2+4e-=2O2- |
分析 A.无隔膜电解饱和NaCl溶液,阴极上氢离子放电生成氢气和NaOH,阳极上氯离子放电生成氯气,氯气与NaOH反应可制备“84”消毒液;
B.钢铁腐蚀的负极上Fe失去电子生成亚铁离子;
C.合金的耐腐蚀性一般较好,如不锈钢,与其结构有关;
D.酸性电解质,正极上氧气得到电子生成水.
解答 解:A.无隔膜电解饱和NaCl溶液,阴极上氢离子放电生成氢气和NaOH,阳极上氯离子放电生成氯气,氯气与NaOH反应可制备“84”消毒液,主要成分为NaCl、NaClO,因NaClO具有强氧化性,有效成分NaClO,故A正确;
B.钢铁腐蚀的负极上Fe失去电子生成亚铁离子,负极反应为Fe-2e-=Fe2+,故B错误;
C.合金的耐腐蚀性一般较好,如不锈钢,与其结构有关,若合金在潮湿的空气中易形成原电池而加快腐蚀,二者无因果关系,故C错误;
D.酸性电解质,正极上氧气得到电子生成水,正极反应为4H++O2+4e-=2H2O,故D错误;
故选A.
点评 本题考查电解与原电池原理,为高频考点,把握发生的电极反应、电化学腐蚀为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
15.实验室用氢气还原氧化铜,正确的操作顺序是( )
| A. | 加热、通氢气、停止加热、继续通氢气至试管冷却 | |
| B. | 通氢气、加热、停止加热、继续通氢气至试管冷却 | |
| C. | 通氢气后立即点燃酒精灯加热 | |
| D. | 停止加热后立即停止通氢气 |
16.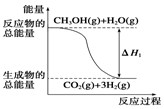 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | 1 mol CH3OH完全燃烧放出192.9 kJ热量 | |
| B. | 反应①中的能量变化如图所示 | |
| C. | CH3OH转变成H2的过程不一定要吸收能量 | |
| D. | 根据②推知:CH3OH(1)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H<-192.9 kJ•mol-1 |
20.按照冶金工业的分类,下列合金属于黑色金属材料的是( )
| A. | 锰钢 | B. | 青铜 | C. | 铝锂合金 | D. | 镧镍储氢合金 |
10.下列有关实验的选项正确的是( )
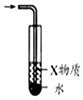
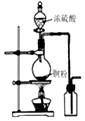
| A.图装置中X为苯,可用于吸收NH3或HCl,并防止倒吸 | B.图装置可用于铜与浓硫酸反应制取并收集二氧化硫 | C.图装置可用于硫酸铜溶液的蒸发浓缩,然后冷却制硫酸铜晶体 | D.记录滴定终点读数为12.20mL |
 |  | 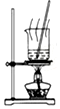 | 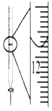 |
| A. | A | B. | B | C. | C | D. | D |
17.进行化学实验必须注意安全,下列说法正确的是( )
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将酸溅到眼中,应立即用烧碱溶液冲洗,边洗边眨眼睛 | |
| C. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上稀硫酸 | |
| D. | 配制稀硫酸,可先在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸 |