题目内容
4.氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体.实验室中制备氯苯的装置如图所示(其中夹持仪器及加热装置略去)
请回答下列问题:
(1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸.打开仪器b中的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是有黄绿色气体生成,用离子方程式表示产生该现象的原因:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O.
(2)仪器b外侧玻璃导管的作用是使浓盐酸能顺利滴下(或答“平衡仪器a、b内的气压”).
(3)仪器d内盛有苯,FeCl3粉末固体,仪器a中生成的气体经过仪器e进入到仪器d中.
①仪器e的名称是洗气瓶,其盛装的试剂名称是浓硫酸.
②仪器d中的反应进行过程中,保持温度在40~60℃,以减少副反应发生.仪器d的加热方式最好是水浴加热,其优点是受热均匀,易于控制温度.
(4)仪器c的作用是冷凝、回流.
(5)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3,HCl及部分Cl2,然后通过碱洗除去Cl2;碱洗后通过分液得到含氯苯的有机物混合物,混合物成分及沸点如表一:
表一
| 有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
| 沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
(6)实际工业生产中,苯的流失如表二:
表二:
| 流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
| 苯流失量(kg/I) | 28.8 | 14.5 | 56.7 | 100 |
分析 a中KMnO4与b中浓盐酸制备氯气,e中浓硫酸干燥氯气,于仪器d中与苯,FeCl3粉末固体制备氯苯,
(1)高锰酸钾与浓盐酸反应生成黄绿色气体氯气;
(2)仪器b外侧玻璃导管的作用是平衡仪器a、b内的气压,使浓盐酸能顺利滴下;
(3)①a中制备的氯气含有水蒸气,需用浓硫酸干燥,进行洗气;
②仪器d中的反应进行过程中,保持温度在40~60℃,为了受热均匀,便于控制温度,选择水浴加热;
(4)仪器c的作用是冷凝回流;
(5)由图表可知,氯苯的沸点为132.2℃,故收集132.2℃作用的馏分;
解答 解:(1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸,混合生成氯气,离子方程式为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,氯气为黄绿色气体,故可观察到仪器a内有黄绿色气体生成;
故答案为:有黄绿色气体生成;2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(2)仪器b外侧玻璃导管的作用是平衡仪器a、b内的气压,使浓盐酸能顺利滴下;
故答案为:使浓盐酸能顺利滴下(或答“平衡仪器a、b内的气压”);
(3)①a中制备的氯气含有水蒸气,需用浓硫酸干燥,进行洗气,e为洗气瓶;
故答案为:洗气瓶;浓硫酸;
②仪器d中的反应进行过程中,保持温度在40~60℃,为了受热均匀,便于控制温度,选择水浴加热;
故答案为:水浴;受热均匀,易于控制温度;
(4)仪器c的作用是冷凝回流;
故答案为:冷凝、回流;
(5)由图表可知,氯苯的沸点为132.2℃,故收集132.2℃作用的馏分;
故答案为:132.2;
(6)苯的总流失量为100Kg/t,故1t苯中参加反应的苯的质量为(1t-0.1t)=0.9t,由苯与氯苯质量之比为78:112.5,则13t 苯可制得成品氯苯为:$\frac{13×0.9×112.5}{78}$t=16.9t;
故答案为:16.9.
点评 本题考查有机物制备实验方案,涉及对装置、操作与原理的分析评价以及化学计算等,是对学生综合能力的考查,难度中等.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | Al3+ | B. | Mg2+ | C. | Cl- | D. | Ba2+ |
| A. | CH4和C12按体积比1:3混合可制得纯净的CHCl3 | |
| B. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| C. | C3H6O2有3种同分异构体,它们均能与钠反应放出氢气 | |
| D. | 人体内的蛋白质分解,最终生成二氧化碳和水排出体外 |
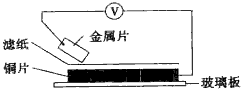 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表 | 金属 | 电子流动方向 | 电压 |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | +0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | 丁→Cu | +0.30 |
| A. | 在四种金属中乙的还原性最强 | |
| B. | 金属乙能从硫酸铜溶液中置换出铜 | |
| C. | 甲、丁若形成原电池时,甲为负极 | |
| D. | 甲、乙形成合金在空气中,乙先被腐蚀 |
I.在实验室中模拟工业利用软锰矿(主要成分为MnO2,含少量SiO2、Fe2O3和A12O3等)制备金属锰等物质,设计流程如图1:

己知:碳酸锰在空气中高温加热固体产物为Mn2O3;部分氢氧化物的Ksp(近似值)如表.
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
(2)向滤液I 中滴加双氧水的目的是将Fe2+氧化为Fe3+,便于转化为Fe(OH)3除去;测得滤液I 中c(Mn2+)=0.1mol•L-1,为保证滴加氨水不产生Mn(OH)2,应控制溶液pH最大为8.
(3)“沉锰”过程中的离子方程式为Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O或Mn2++HCO3-+NH3=MnCO3↓+NH4+.
(4)以Mn2O3和金属铝为原料可以制备粗锰,写出化学反应方程式Mn2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Mn.
II.科学家发明了NH3燃料电池,以KOH为电解质,原理如图2所示.
(5)该燃料电池的负极反应式为2NH3+6OH--6e-=N2+6H2O.
| A. | 该溶液的pH不可能是7 | B. | 该溶液的pH一定是4 | ||
| C. | 该溶液的pH一定是10 | D. | 不会有这样的溶液 |
 在“天宫二号”上蚕宝宝的“太空屋”形似胶囊(如图),两端的半球体由航天铝合金打造,中间部分采用透明有机玻璃,蚕宝宝由聚氨酯海绵包裹着.
在“天宫二号”上蚕宝宝的“太空屋”形似胶囊(如图),两端的半球体由航天铝合金打造,中间部分采用透明有机玻璃,蚕宝宝由聚氨酯海绵包裹着.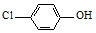 )的废水可以利用微生物电池除去,其原理如图1所示.
)的废水可以利用微生物电池除去,其原理如图1所示.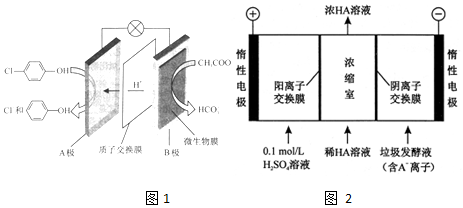
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-
-OH+Cl-