题目内容
12.能表示阿伏加德罗常数数值的是( )| A. | 1 mol金属钠含有的电子数 | |
| B. | 0.012 kg 12C中含有的碳原子数 | |
| C. | 1 mol H2SO4完全溶于水后电离出的H+的个数 | |
| D. | 27 g Al与足量稀硫酸反应后生成H2的分子数 |
分析 A、钠原子含11个电子;
B、0.012 kg 12C中含有的碳原子数即为阿伏伽德罗常数;
C、硫酸是二元强酸;
D、求出铝的物质的量,然后根据2mol铝生成3mol氢气来分析.
解答 解:A、每个钠原子含11个电子,则1 mol金属钠含有的电子数为11 NA,故A错误;
B、0.012 kg 12C中含有的碳原子数即为阿伏伽德罗常数,此为阿伏伽德罗常数的定义,故B正确;
C、由于硫酸是二元强酸,故1 mol H2SO4完全溶于水后电离出的H+数为2NA,故C错误;
D、27g即1molAl,由于2mol铝生成3mol氢气,故1mol铝与足量稀硫酸反应后生成的H2的分子数为1.5NA,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
2.化学在生产和生活中有重要的应用.下列说法正确的是( )
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
3.某离子反应中共有H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中C(ClO-)随反应进行逐渐减小.下列判断错误的是( )
| A. | 该反应的还原剂是NH4+ | |
| B. | 消耗1mol氧化剂,转移2mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比是2:3 | |
| D. | 反应后溶液酸性明显增强 |
7.使用石油热裂解的副产物CH4来制取CO和H2,其生产流程如图:
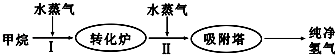
(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇.
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0kJ•mol-1和726.5kJ•mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ•mol-1.
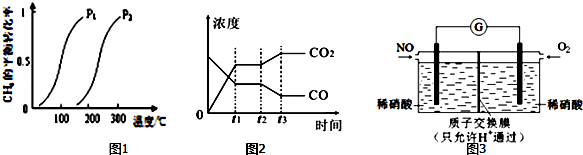
此流程的第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图1.则P1<P2.(填“<”、“>”或“=”)100℃时,将1mol CH4和2mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=2.25×10-2.
(3)此流程的第Ⅱ步反应CO(g)+H2O(g)?CO2(g)+H2(g),的平衡常数随温度的变化如表:
从上表可以推断:该反应是放热反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时,CO的转化率为75%.图2表示该反应在t1时刻达到平衡、在t2时刻因改变某个条件引起浓度变化的情况:图2中t2时刻发生改变的条件是降低温度.增加水蒸汽的量或减少氢气的量(写出一种).
(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图3,电极为多孔惰性材料.则负极的电极反应式是2H2O+NO-3e-=NO3-+4H+.

(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇.
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0kJ•mol-1和726.5kJ•mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ•mol-1.
此流程的第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图1.则P1<P2.(填“<”、“>”或“=”)100℃时,将1mol CH4和2mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=2.25×10-2.
(3)此流程的第Ⅱ步反应CO(g)+H2O(g)?CO2(g)+H2(g),的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图3,电极为多孔惰性材料.则负极的电极反应式是2H2O+NO-3e-=NO3-+4H+.

17.室温下,取浓度相同的NaOH和HCl溶液,以3:1体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
| A. | 0.01 mol/L | B. | 0.02 mol/L | C. | 0.05 mol/L | D. | 0.06 mol/L |
4.FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断正确的是( )
| A. | 加入KSCN溶液不一定变红色 | B. | 溶液中一定含Fe2+ | ||
| C. | 溶液中一定含Cu2+ | D. | 剩余固体中一定含Cu和Fe |
1.反应2SO2+O2?2SO3(△H<0)达到平衡时,要想使平衡向右移动,应采取的措施是( )
| A. | 减小压强 | B. | 升高温度 | C. | 增加SO2浓度 | D. | 加入催化剂 |
12.用惰性电极电解2L 1.0mol/L CuSO4溶液,在电路中通过0.5mol电子后,调换正负极继续电解,电路中通过了1mol电子,此时溶液中c(H+)为(假设体积不变)( )
| A. | 1.5 mol/L | B. | 0.5mol/L | C. | 0.75 mol/L | D. | 0.25 mol/L |
