题目内容
1.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )| 实验 | 现象 | 结论 | |
| A | Fe(OH )3 胶体通电后 | 阴极区红褐色加深 | Fe(OH)3胶体带 正电 |
| B | 将铜粉加入 1.0mol•L-1 的Fe2(SO4)3溶液中 | 溶液变蓝,有黑色固体出现 | 金属Fe比Cu活 泼 |
| C | 用坩埚钳夹住用砂纸 仔细打磨过的铝箔在 酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点比 较低 |
| D | 向盛有少量浓硝酸、 稀硝酸的两支试管中 分别加入一片大小相 同的铜片 | 浓硝酸中铜片很快开始溶解,并放出 红棕色气体;稀硝酸中过一会铜片表 面才出现无色气体,气体遇空气变红 棕色 | 浓硝酸氧化性强 于稀硝酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.胶体不带电;
B.Cu与硫酸铁反应生成硫酸铜、硫酸亚铁;
C.氧化铝的熔点高,包裹在Al的外面;
D.浓硝酸与Cu反应速率快.
解答 解:A.胶体不带电,由电泳现象可知,Fe(OH)3胶体粒子带正电,故A错误;
B.Cu与硫酸铁反应生成硫酸铜、硫酸亚铁,不能生成黑色固体,故B错误;
C.氧化铝的熔点高,包裹在Al的外面,则熔化后的液态铝不能滴落下来,现象不合理,故C错误;
D.由操作及现象中浓硝酸与Cu反应速率快,可知浓硝酸氧化性强于稀硝酸,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
11.已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;
②Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
②Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为 283 kJ | |
| B. | 反应①正反应活化能与逆反应活化能之差为+566 kJ/mol | |
| C. | 反应 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 6.02×1023 |
16.下列7种物质内部存在正四面体结构的最大组合是( )
①白磷 ②甲烷 ③四氯化碳 ④金刚石 ⑤二氧化硅 ⑥铵根 ⑦氯仿.
①白磷 ②甲烷 ③四氯化碳 ④金刚石 ⑤二氧化硅 ⑥铵根 ⑦氯仿.
| A. | ①②④⑦ | B. | ①②③④ | C. | ①②③⑥ | D. | ①②③④⑤⑥ |
13.将20gNaHCO3 固体加热一段时间,冷却、称量剩余固体质量为13.8g,则此NaHCO3 的分解百分率为( )
| A. | 84% | B. | 42% | C. | 53% | D. | 67% |
10.近些年地球上地震、海啸、飓风时有发生,全球气温持续上升,部分冰川开始融化、为此我们应该用实际行动来保护我们的家园--地球.下列有关说法正确的是( )
| A. | CO2、CH4、氟氯代烃等都会造成温窒效应,因此都属于大气污染物 | |
| B. | 测定某地区的酸雨发现经过一段时间之后pH下降,判断为硝酸型酸雨 | |
| C. | 低碳经济主要与工厂、汽车排放有关,与人们用电、用水、用纸等是否节约无关 | |
| D. | 绿色化学的核心是利用化学原理对环境污染进行治理 |
9. 实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ、配制0.50mol/L KOH溶液:
若实验中大约要使用230mL KOH溶液,至少需要称量KOH固体7.0g.
Ⅱ、测定稀硫酸与氢氧化钾溶液反应的中和热:
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、量筒、环形玻璃搅拌棒,尚缺少的玻璃仪器是温度计.
(2)取50mL KOH溶液和30mL硫酸溶液进行实验,实验数据如表:
①请填写表中的空白:
②近似认为0.50mol/L KOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容为c=4.18J/(g•℃),则中和热△H=-53.50 kJ•mol-1.
(3)某同学进行该实验时未找到环形玻璃搅拌棒,实验中他用铜丝代替环形玻璃棒进行搅拌,测得的中和热的数值会偏小(填“偏大”“偏小”或“无影响”),原因是:铜丝是热的良导体,导致热量散失.
Ⅲ、某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
(1)实验①和②的目的是探究浓度对反应速率的影响.
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(填一种即可).
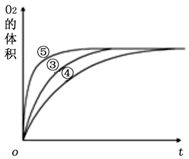
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示.分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
 实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ、配制0.50mol/L KOH溶液:
若实验中大约要使用230mL KOH溶液,至少需要称量KOH固体7.0g.
Ⅱ、测定稀硫酸与氢氧化钾溶液反应的中和热:
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、量筒、环形玻璃搅拌棒,尚缺少的玻璃仪器是温度计.
(2)取50mL KOH溶液和30mL硫酸溶液进行实验,实验数据如表:
①请填写表中的空白:
| 项目 数据 次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值 (T2-T1)/℃ | ||
| H2SO4 | KOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 | |
(3)某同学进行该实验时未找到环形玻璃搅拌棒,实验中他用铜丝代替环形玻璃棒进行搅拌,测得的中和热的数值会偏小(填“偏大”“偏小”或“无影响”),原因是:铜丝是热的良导体,导致热量散失.
Ⅲ、某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol•L-1 X溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol•L-1 X溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol•L-1 X溶液 |
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(填一种即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示.分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
 .
.