题目内容
1.下列分子中,空间构型是平面三角形的是( )| A. | BeCl2 | B. | BF3 | C. | CCl4 | D. | H2O |
分析 微粒的空间构型是平面三角形,说明中心原子价层电子对个数是3且不含孤电子对,价层电子对个数=σ键个数+孤电子对个数,据此判断.
解答 解:A.BeCl2中Be原子孤电子对数为0,价层电子对数为2+0=2,为直线型结构,故A不符合;
B.BF3中B原子孤电子对数为0,价层电子对数为3+0=3,为平面三角形结构,故B符合;
C.CCl4中C原子孤电子对数为0,价层电子对数为4+0=4,为正四面体结构,故C不符合;
D.H2O中O原子孤电子对数为$\frac{6-1×2}{2}$=2,价层电子对数为3+2=4,为V形结构,故D不符合,
故选:B.
点评 本题考查微粒空间构型的判断,根据价层电子对互斥理论来分析解答即可,难点是孤电子对个数的计算,难度中等.

练习册系列答案
相关题目
11.以下有关元素性质的说法不正确的是( )
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列最外层电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、O、S ③Si、P、As ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ | |
| D. | 某元素基态原子的逐级电离能分别为578、1817、2745、11575、14830、18376、23293,当它与氯气反应时可能生成的阳离子是X2+ |
12.关于浓度均为0.1mol•L-1的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是( )
| A. | c(NH4+):③>① | |
| B. | 水电离出的c(H+):②>① | |
| C. | ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3•H2O) | |
| D. | ①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
9.下列物质属于同系物的是( )
| A. | CH3CH2CH2OH与CH3CH2OCH3 | B. |  与 与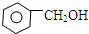 | ||
| C. | CH3COOH与HCOOCH2CH3 | D. | CH3CH2CH2CHO与(CH3)2CHCH2CHO |
6.下列对CO2的说法正确的是( )
| A. | 由非极性键构成的非极性分子 | B. | 中心原子的杂化方式是sp2 | ||
| C. | 该分子的空间构型是平面三角形 | D. | 1mol该分子有2mol σ键 |
13.对于可逆反应4NH3+5O2?4NO+6H2O(g),下列叙述正确的是( )
| A. | 达到平衡时,4v(O2)正=5v(NO)逆 | |
| B. | 达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量之比为4:5:4:6 | |
| C. | 达到平衡状态时,若增加容器体积,则反应速率增大 | |
| D. | 若单位时间生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态 |
10.“混盐”是指一种金属离子与多种酸根阴离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐.“复盐”是指含多种简单阳离子和一种酸根阴离子构成的盐,如:KAl(SO4)2.下列化合物中属于“混盐”的是( )
| A. | BiONO3 | B. | (NH4)2Fe(SO4)2 | C. | Ca(ClO)Cl | D. | K3Fe(CN)6 |
11.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 1mol H2中含有的电子数为2NA | |
| B. | 22.4L氧气所含的氧原子数为2NA | |
| C. | 常温常压下,28g氮气所含的原子数为NA | |
| D. | 2g氢气所含的氢原子数为NA |