题目内容
10.“混盐”是指一种金属离子与多种酸根阴离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐.“复盐”是指含多种简单阳离子和一种酸根阴离子构成的盐,如:KAl(SO4)2.下列化合物中属于“混盐”的是( )| A. | BiONO3 | B. | (NH4)2Fe(SO4)2 | C. | Ca(ClO)Cl | D. | K3Fe(CN)6 |
分析 盐是由金属阳离子(铵根离子)和酸根阴离子组成的化合物,再结合题中信息和盐的定义进行分析判断,一种阳离子和多种阴离子构成的盐为混盐,一种阴离子和多种阳离子构成的盐为复盐,据此分析物质组成判断.
解答 解:A、BiONO3只有一种酸根离子,不是混盐,故A错误;
B、(NH4)2Fe(SO4)2含有两种阳离子和一种酸根阴离子,不是混盐,复盐,故B错误;
C、Ca(ClO)Cl的化学式分析,该物质是由一种金属阳离子和两种酸根离子构成的,因此属于混盐,故C正确;
D、K3[Fe(CN)6]含有一种阳离子和一种酸根阴离子的盐,不是复盐,也不是混盐,故D错误;
故选C.
点评 本题是信息给予题,注意根据盐的概念和题目中信息分析解答,考查学生提练加工信息的能力,题目较简单.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
20.下列关于甲烷(CH4)和氧气(O2)说法正确的是( )
| A. | 同温同压下甲烷和氧气的密度之比为2:1 | |
| B. | 1g甲烷和1g氧气的原子数之比为5:1 | |
| C. | 等物质的量的甲烷和氧气的质量之比为2:1 | |
| D. | 在标准状况下等质量的甲烷和氧气的体积之比为1:2 |
1.下列分子中,空间构型是平面三角形的是( )
| A. | BeCl2 | B. | BF3 | C. | CCl4 | D. | H2O |
18.下列金属冶炼的反应原理,错误的是( )
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$ 2Na+Cl2↑ | B. | MgO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$Mg+H2O | ||
| C. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$ 3Fe+4CO2 | D. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2 |
15.下列离子方程式正确的是( )
| A. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | 氯化铁溶液和铜反应:Fe3++Cu═Fe2++Cu2+ | |
| C. | 石灰水与碳酸氢钠溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
2.在与Al反应能放出H2的溶液中,一定能大量共存的离子组是( )
| A. | K+、Na+、HCO3-、Cl- | B. | K+、NO3-、Cl-、I- | ||
| C. | Na+、Cl-、I-、SO42- | D. | NH4+、Al3+、Cl-、SO42- |
19.分类是学习和研究化学的一种重要方法,下列分类合理的是( )
| A. | H2SO4和HNO3都属于酸 | B. | Na2CO3和Na2O都属于盐 | ||
| C. | NaOH 和Na2CO3都属于碱 | D. | Na2O和Na2SiO3都属于氧化物 |
20.某非金属元素R的氢化物及其氧化物、盐之间具有如下转化关系(部分产物省略):氢化物$\stackrel{氧气}{→}$B$\stackrel{Na_{2}O_{2}}{→}$ C,下列判断中正确的是( )
| A. | 若R是硫元素、则C是Na2SO3 | B. | 若R是硅元素、则C是Na2Si03 | ||
| C. | 若R是碳元素、则C是Na2CO3 | D. | 若R是氯元素、则C是NaCl |
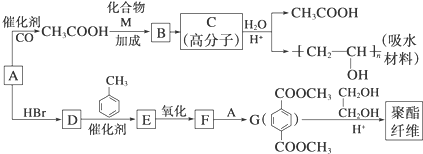
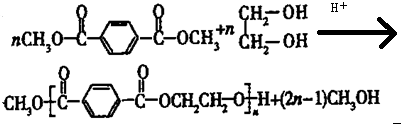 .
.