题目内容
3.下列试剂中,标签上应标注 和
和 的是( )
的是( )| A. | 氨水 | B. | 碳酸钠 | C. | 盐酸 | D. | 浓硫酸 |
分析 试剂的标签上应标注 和
和 ,说明该试剂具有强氧化性和腐蚀性,如浓硫酸、硝酸等,据此进行解答.
,说明该试剂具有强氧化性和腐蚀性,如浓硫酸、硝酸等,据此进行解答.
解答 解:A.氨水具有腐蚀性,但不具有氧化性,不能用标签 ,故A错误;
,故A错误;
B.碳酸钠不具有强氧化性,故B错误;
C.盐酸具有腐蚀性,但是不具有强的氧化性,故C错误;
D.浓硫酸具有强的氧化性和腐蚀性,应标注 和
和 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见试剂的性质及警示标记,题目难度不大,明确警示标记的含义为解答关键,注意熟练掌握常见化学试剂的性质及分类,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列说法正确的是( )
| A. | 最外层有4个电子的原子都是非金属原子 | |
| B. | 同一主族的两种元素的原子序数之差不可能是44 | |
| C. | COCl2分子和CCl4分子中所有原子都满足最外层8电子结构 | |
| D. | 同主族金属的原子,半径越大,熔点越高 |
14.同周期的A、B、D三种元素,其最高价氧化物对应水化物的酸性强弱顺序是HAO4>H2BO4>H3DO4,则下列判断错误的是( )
| A. | 气态氢化物稳定性HA>H2B>DH3 | B. | 原子半径A>B>D | ||
| C. | 非金属性A>B>D | D. | 阴离子还原性B2->A- |
11.向盛有H2O2的试管中滴入一定量浓盐酸,有刺激性气味的气体生成.经实验证明该气体只含有O2、Cl2、HCl和水蒸气.将气体通入X溶液(如下图),依据观察到的现象,能判断气体中含有Cl2的是( )
| X溶液 | 现象 | 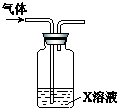 | |
| A | 紫色石蕊溶液 | 溶液先变红后褪色 | |
| B | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
| C | 滴有KSCN的FeSO4溶液 | 溶液变为红色 | |
| D | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
18.下列各组离子或分子能大量共存,当加入相应试剂后,发生反应的离子方程式书写正确的是( )
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O |
| B | Na+、OH-、Cl- | 少量Mg(HCO3)2溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
8.化学与人类的生活、生产息息相关,下列叙述正确的是( )
| A. | “春蚕到死丝方尽、蜡炬成灰泪始干”中的“丝”的主要成分是纤维素,属于天然高分子化合物 | |
| B. | “千锤万凿出深山,烈火焚烧若等闲”的过程中不但有物理变化,也有化学变化 | |
| C. | 日常生活中常用汽油去除衣物上的油污,用热的纯碱溶液洗涤炊具上的油污,两者的原理完全相同 | |
| D. | “84”消毒液的有效成分为NaClO,“洁厕灵”的有效成分为HCl,若将两者混合使用,其杀菌效果和去除厕所污渍的效果都将加强 |
15.多晶硅是太阳能光伏产业的基础材料.制备多晶硅必须先得到高纯硅.三氯甲硅烷(SiHCl3)是一种可燃,易与水反应的气体,当前制备高纯硅的主要方法是在一定条件下以三氯甲硅烷为原料用氢气还原,其生产流程如图所示:

(1)①流化床反应器中主要反应的化学方程式是Si+3HCl$\frac{\underline{\;高温\;}}{\;}$SiHCl3+H2,
在生成的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏.
②整个制备过程中必须保证无水无氧.SiHCl3遇H2O剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式:SiHCl3+3H2O═H2SiO3↓+3HCl↑+H2↑.
③H2还原SiHCl3过程中若混入O2,可能引起的后果是O2与SiHCl3、H2混合可能引起爆炸.
(2)该工艺流程可循环利用的物质是H2和HCl.
(3)Na2SiO3的水溶液俗称水玻璃,用水玻璃可制得高纯度SiO2.取少量水玻璃于试管中,逐滴加入饱和NH4Cl溶液,振荡.观察到的实验现象是试管中有白色胶状沉淀生成,有刺激性气味气体生成.
(4)电弧炉中制得的粗硅中含有副产物SiC,已知其中Si和SiC的物质的量之比为2:1,
制取粗硅时的化学方程式是3SiO2+7C═2Si+SiC+6CO↑,
若在反应中生成了2.8g Si,则转移电子数为0.6NA或3.612×1023.

| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2 355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
在生成的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏.
②整个制备过程中必须保证无水无氧.SiHCl3遇H2O剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式:SiHCl3+3H2O═H2SiO3↓+3HCl↑+H2↑.
③H2还原SiHCl3过程中若混入O2,可能引起的后果是O2与SiHCl3、H2混合可能引起爆炸.
(2)该工艺流程可循环利用的物质是H2和HCl.
(3)Na2SiO3的水溶液俗称水玻璃,用水玻璃可制得高纯度SiO2.取少量水玻璃于试管中,逐滴加入饱和NH4Cl溶液,振荡.观察到的实验现象是试管中有白色胶状沉淀生成,有刺激性气味气体生成.
(4)电弧炉中制得的粗硅中含有副产物SiC,已知其中Si和SiC的物质的量之比为2:1,
制取粗硅时的化学方程式是3SiO2+7C═2Si+SiC+6CO↑,
若在反应中生成了2.8g Si,则转移电子数为0.6NA或3.612×1023.
12.下列关于各图象的解释或得出结论正确的是( )
| A. | 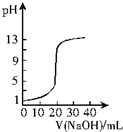 图表示0.10 mol•L-1 NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. | 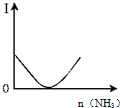 图表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 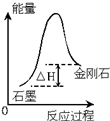 根据图所示可知:金刚石生成石墨为放热反应 | |
| D. | 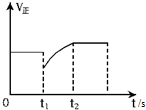 图表示反应2SO2+O2?2SO3,t1时刻只小了的SO3的浓度 |
 .
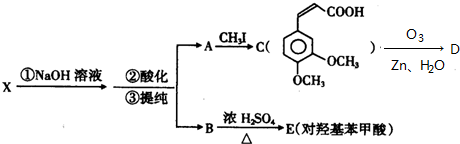
.
 ;
;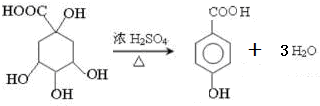 ;
;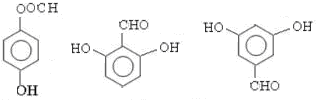 任意一种;(任写一种)
任意一种;(任写一种)