题目内容
12.下列关于各图象的解释或得出结论正确的是( )| A. | 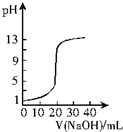 图表示0.10 mol•L-1 NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. | 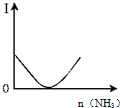 图表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 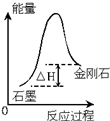 根据图所示可知:金刚石生成石墨为放热反应 | |
| D. | 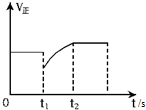 图表示反应2SO2+O2?2SO3,t1时刻只小了的SO3的浓度 |
分析 A、醋酸为弱酸,0.1000mol/L的醋酸溶液pH应大于1;
B、乙酸是弱电解质,随通入氨气发生反应生成醋酸铵是盐完全电离,导电性增强;
C、物质能量越高越活泼,由图象可知金刚石能量比石墨能量高,据此判断反应的吸放热;
D、t1时刻只减小的SO3的浓度,此时正反应速率在原平衡点,随反应进行减小.
解答 解:A、由图象可知曲线起始点pH=1,醋酸为弱酸,0.1000mol/L的醋酸溶液pH应大于1,故A错误;
B、乙酸是弱电解质,随通入氨气发生反应生成醋酸铵,CH3COOH+NH3=CH3COONH4,CH3COONH4是盐,水溶液中完全电离,溶液导电性应先增强,图象中导电性减弱,故B错误;
C、物质能量越高越活泼,图象中金刚石能量比石墨能量高,金刚石生成石墨为放热反应,故C正确;
D、t1时刻只减小的SO3的浓度,此时逆反应速率突然减小,而此时正反应速率应在原平衡点,然后随反应进行减小,故D错误;
故选C.
点评 本题考查了化学图象的分析判断,主要是弱电解质电离平衡,溶液导电性强弱判断,化学平衡影响因素分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
2.标准状况下aL氨气溶于1000g 水中,所得氨水密度为b g/mL,则该氨水的物质的量浓度为( )
| A. | $\frac{ab}{22400}$mol•L-1 | B. | $\frac{ab}{22400+17a}$mol•L-1 | ||
| C. | $\frac{1000ab}{22400+35a}$mol•L-1 | D. | $\frac{1000ab}{22400+17a}$mol•L-1 |
3.下列试剂中,标签上应标注 和
和 的是( )
的是( )
 和
和 的是( )
的是( )| A. | 氨水 | B. | 碳酸钠 | C. | 盐酸 | D. | 浓硫酸 |
17.乳酸的一种合成方法: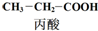 $→_{①}^{Cl_{2},红磷}$
$→_{①}^{Cl_{2},红磷}$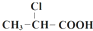 $→_{②}^{一定条件}$
$→_{②}^{一定条件}$ 下列说法正确的是( )
下列说法正确的是( )
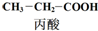 $→_{①}^{Cl_{2},红磷}$
$→_{①}^{Cl_{2},红磷}$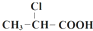 $→_{②}^{一定条件}$
$→_{②}^{一定条件}$ 下列说法正确的是( )
下列说法正确的是( )| A. | 步骤①、②分别是加成反应、取代反应 | B. | 蛋白质水解也可生成乳酸 | ||
| C. | 丙酸烃基上的二氯代物有2种 | D. | 乳酸与丙烯完全燃烧的产物相同 |
4.我国南朝(梁)陶弘景著《本草经集注》中记叙药物730种,其中“消石”条目下写道:“…如握雪不冰.强烧之,紫青烟起,仍成灰…”.这里的“消石”是指( )
| A. | 氯化钠 | B. | 硝酸按 | C. | 高锰酸钾 | D. | 硝酸钾 |
2.下列有关物质的性质和应用都正确的是( )
| A. | BaSO4的水溶液不导电,故BaSO4是弱电解质 | |
| B. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也不存在同分异构体 | |
| C. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 | |
| D. | AgCl在同温、同浓度的CaCl2和NaCl溶液中的溶解度不同 |