题目内容
5.某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.(1)他们能完成哪些因素对速率影响的探究?硝酸浓度、温度、大理石表面积.
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 细颗粒 | 2.00 |
| ② | 常温 | 细颗粒 | 1.00 |
| ③ | 35℃ | 粗颗粒 | 2.00 |
| ④ | 35℃ | 细颗粒 | 2.00 |
(4)该实验小组用如图实验装置进行实验.
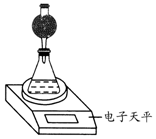
①除电子天平、干燥管、锥形瓶、药匙、胶塞、量筒等仪器外,必需的实验仪器还有秒表.
②干燥管中应放置的试剂是B.
A.碱石灰 B.无水CaCl2C.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”、“偏小”或“不变”).
分析 (1)由信息可知,硝酸的浓度不同、大理石的接触面积不同、温度不同;
(2)①②只控制浓度不同,③④控制接触面积不同;
(3)由控制变量法可知,硝酸溶液的体积、固体的质量不变;
(4)①测定反应速率需要测定时间;
②干燥管吸收水,排出二氧化碳气体,前后的质量差为气体的质量;
③若撤除干燥管装置,气体的质量偏大.
解答 解:(1)由信息可知,硝酸的浓度不同、大理石的接触面积不同、温度不同,则可完成硝酸浓度、温度、大理石表面积对速率影响,
故答案为:硝酸浓度、温度、大理石表面积;
(2)①②只控制浓度不同,③④控制接触面积不同,则②为常温,③为粗颗粒,④为细颗粒,故答案为:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | |||
| ② | 常温 | ||
| ③ | 粗颗粒 | ||
| ④ | 细颗粒 |
(3)由控制变量法可知,硝酸溶液的体积、固体的质量不变,故答案为:硝酸溶液体积;
(4)①测定反应速率需要测定时间,则还需要的仪器为秒表,故答案为:秒表;
②干燥管吸收水,排出二氧化碳气体,前后的质量差为气体的质量,则干燥管中应放置的试剂是无水CaCl2,故答案为:B;
③若撤除干燥管装置,气体的质量偏大,则测定反应速率偏大,故答案为:偏大.
点评 本题考查反应速率的实验探究,为高频考点,把握温度、浓度、接触面积对反应速率的影响为解答的关键,侧重分析与实验能力的考查,注意控制变量法的应用,题目难度不大.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
17.25℃时,下列有关溶液中各微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/L的NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1mol/L的CH3COONa:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) | |
| C. | 某FeCl3溶液pH=4:c(Cl-)>c(H+)>c(Fe3+)>c(OH-) | |
| D. | 某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)═c(H+)+c(Na+) |
16.下列有关卤素单质及其化合物的说法正确的是( )
| A. | 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 | |
| B. | 卤化氢的稳定性按HF、HCl、HBr、HI的顺序依次增大 | |
| C. | 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 | |
| D. | 卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深 |
13.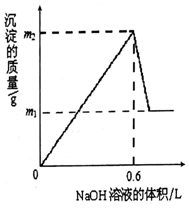 将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )
将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )
 将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )
将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )| A. | m1-m2═10.2 | B. | 2c(H2SO4)+c(HNO3)═0.8 mol•L-1 | ||
| C. | 原合金中铝的质量分数为34.7% | D. | V=2.24 |
15.下列反应中,硝酸只表现氧化性的是( )
| A. | 3FeO+10HNO3═3Fe(NO3)3+NO↑+5H2O | B. | C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O | ||
| C. | Al(OH)3+3HNO3═Al(NO3)3+3H2O | D. | 3Zn+8HNO3═3Zn(NO3)2+2NO↑+4H2O |
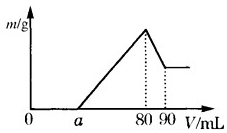 (1)把一定质量的镁、铝混合物投入到 2mol•L-1 的盐酸中,待金属完全溶解后,向溶液中加入 2mol•L-1 的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:
(1)把一定质量的镁、铝混合物投入到 2mol•L-1 的盐酸中,待金属完全溶解后,向溶液中加入 2mol•L-1 的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则: