题目内容
17.25℃时,下列有关溶液中各微粒的物质的量浓度关系正确的是( )| A. | 0.1mol/L的NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1mol/L的CH3COONa:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) | |
| C. | 某FeCl3溶液pH=4:c(Cl-)>c(H+)>c(Fe3+)>c(OH-) | |
| D. | 某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)═c(H+)+c(Na+) |
分析 A.NH4Cl中铵根离子水解,且水解显酸性;
B.CH3COONa中醋酸根离子水解,且水解显碱性;
C.FeCl3溶液pH=4,可知水解显酸性,且铁离子沉淀完全;
D.酸式盐NaHA溶液中,遵循电荷守恒.
解答 解:A.NH4Cl中铵根离子水解,且水解显酸性,水解程度不大,显性离子大于隐性离子,则离子浓度为c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B.CH3COONa中醋酸根离子水解,且水解显碱性,水解程度不大,显性离子大于隐性离子,则离子浓度为c(Na+)>c(CH3COO-)>c(H+)>c(CH3COOH)>c(OH-),故B错误;
C.FeCl3溶液pH=4,pH在3.7左右沉淀完全,可知水解显酸性,则c(Cl-)>c(H+)>c(Fe3+)>c(OH-),故C正确;
D.弱酸的酸式盐NaHA溶液中,遵循电荷守恒,则c(OH-)+c(HA-)+2c(A2-)═c(H+)+c(Na+),故D错误;
故选C.
点评 本题考查离子浓度大小的比较,为高频考点,把握盐类水解、离子浓度比较、电荷守恒为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
8.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 标准状况下,22.4L氯气与足量铁粉充分反应,转移的电子数为2NA | |
| B. | 28g乙烯和环丁烷的混合气体中含有的碳原子数为3NA | |
| C. | 0.5molNa2O2中含有NA个阴离子 | |
| D. | 1L0.1mol/LAl2(SO4)3溶液中含有的阳离子总数为0.2NA |
12.美国天文学家在亚利桑那州一天文观测台,探测到距银河系中心2.6亿光年处一巨大气云中的特殊电磁波,这种电磁波表明那里可能有乙醇醛糖(HOCH2CHO)分子存在,下列有关乙醇醛糖的说法不正确的是( )
| A. | HOCH2CHO能发生取代反应、加成反应、氧化反应 | |
| B. | 乙醇醛糖是一种有机物,能燃烧,可溶于水 | |
| C. | HOCH2CHO与乙酸、甲酸甲酯互为同分异构体 | |
| D. | 乙醇醛糖与葡萄糖具有相似的化学性质,且互为同系物 |
2. α-亚麻酸是人体必需的重要不饱和脂肪酸,具有增强智力、提高记忆力、保护视力、改善睡眠的作用.其结构简式如图所示,下列相关说法中不正确的是( )
α-亚麻酸是人体必需的重要不饱和脂肪酸,具有增强智力、提高记忆力、保护视力、改善睡眠的作用.其结构简式如图所示,下列相关说法中不正确的是( )
 α-亚麻酸是人体必需的重要不饱和脂肪酸,具有增强智力、提高记忆力、保护视力、改善睡眠的作用.其结构简式如图所示,下列相关说法中不正确的是( )
α-亚麻酸是人体必需的重要不饱和脂肪酸,具有增强智力、提高记忆力、保护视力、改善睡眠的作用.其结构简式如图所示,下列相关说法中不正确的是( )| A. | α-亚麻酸的分子式为C18H30O2 | |
| B. | α-亚麻酸能使酸性高锰酸钾溶液褪色 | |
| C. | α-亚麻酸在一定条件下能发生酯化反应与取代反应 | |
| D. | 1molα-亚麻酸最多能与4molBr2发生加成反应 |
7.下列说法正确的是( )
| A. | SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊试液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | 等物质的量的SO2和Cl2相遇在溶液中具有漂白能力 |
4.下列表述正确的是( )
| A. | 比例模型为 ,可以表示甲烷分子,也可以表示四氯化碳分子 ,可以表示甲烷分子,也可以表示四氯化碳分子 | |
| B. | 2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO | |
| C. | 二氧化硫、氨、煤的液化均为物理变化 | |
| D. | 实验室中制取乙酸乙酯的方程式为CH3COOH+H18O-C2H5CH3COOC2H5+H218O |
5.某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
(1)他们能完成哪些因素对速率影响的探究?硝酸浓度、温度、大理石表面积.
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
(3)整个实验中应控制的不变量是硝酸溶液体积和大理石质量.
(4)该实验小组用如图实验装置进行实验.
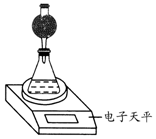
①除电子天平、干燥管、锥形瓶、药匙、胶塞、量筒等仪器外,必需的实验仪器还有秒表.
②干燥管中应放置的试剂是B.
A.碱石灰 B.无水CaCl2C.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”、“偏小”或“不变”).
(1)他们能完成哪些因素对速率影响的探究?硝酸浓度、温度、大理石表面积.
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 细颗粒 | 2.00 |
| ② | 常温 | 细颗粒 | 1.00 |
| ③ | 35℃ | 粗颗粒 | 2.00 |
| ④ | 35℃ | 细颗粒 | 2.00 |
(4)该实验小组用如图实验装置进行实验.

①除电子天平、干燥管、锥形瓶、药匙、胶塞、量筒等仪器外,必需的实验仪器还有秒表.
②干燥管中应放置的试剂是B.
A.碱石灰 B.无水CaCl2C.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”、“偏小”或“不变”).