题目内容
5.已知某密闭容器中发生反应:X(g)+Y(g)?2W(g)+Z(g)△H<0 (Y 物质易被液化).下列有关说法中一定正确的是( )| A. | 若W为有颜色的物质,达平衡后,增大压强,体系颜色变浅 | |
| B. | 改变压强,该反应的平衡常数不变 | |
| C. | 平衡时,其他条件不变,升高温度,正反应速率增大程度比逆反应速率增大程度小 | |
| D. | 平衡时,其他条件不变,分离出 Z,正反应速率加快 |
分析 A.体积减小加压时,气体颜色变深;
B.平衡常数只随温度变化,物质状态改变,平衡常数改变;
C.升温时平衡逆向移动,正逆反应速率都会加快,但逆反应速率大于正反应速率;
D.分离出Z时,正反应速率逐渐减慢;
解答 解:A.增大压强时,容器的容积缩小,W浓度增大,体系颜色变深,故A错误;
B.平衡常数只随温度变化,不随浓度变化,Y物质易被液化,改变压强变化为液体,平衡常数就发生改变,故B错误;
C.升温时平衡逆向移动,正逆反应速率都会加快,但逆反应速率大于正反应速率,故C正确;
D.分离出Z时,正反应速率开始不变但逐渐减慢,故D错误;
故选C.
点评 本题考查了化学平衡的调控作用,题目难度中等,明确影响化学平衡的影响因素为解答关键,B为易错点,注意反应物质状态的变化.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
16.下列说法正确的是( )
| A. | 溶液和胶体的本质区别是丁达尔效应 | |
| B. | 液氨、氨水属于纯净物,盐酸和豆浆属于混合物 | |
| C. | 胶体区别于其它分散系的本质特征是粒子大小 | |
| D. | 能进行“交叉分类”的就不能进行“树状分类” |
10.下列离子方程式正确的为( )
| A. | 少量NaHCO3与过量Ca(OH)2反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| B. | 在CuSO4溶液中加Ba(OH)2溶液 SO42-+Ba2+═BaSO4↓ | |
| C. | Na2S溶液中通入H2S气体 S2-+H+═HS- | |
| D. | NaHCO3溶液与KHSO4溶液反应 HCO3-+H+═CO2↑+H2O |
17.下列实验操作正确的是( )
| A. | 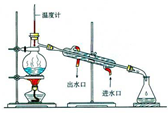 用如图装置分离甲苯和水 | |
| B. | 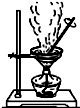 蒸干NH4Cl溶液制备NH4Cl晶体 | |
| C. | 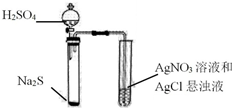 证明Ag2S溶解度小于AgCl | |
| D. | 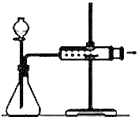 关闭分液漏斗活塞,向外拉动针筒活塞,松开后活塞恢复原位置,证明装置气密性良好 |
14.阿伏加德罗曾做过这样一个实验:“一抽真空的密闭容器重M g,在标准状况下,盛满以相同物质的量混合的NO和H2的混合气体后,称量为(M+Q)g.把混合气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的_边托盘上放置_ g砝码…”横线上分别应填的是( )
| A. | 右 (M+2Q) | B. | 左 (M+2Q) | C. | 右 (M+4Q) | D. | 左 (M+4Q) |
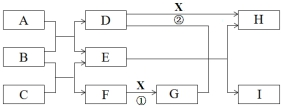
15.溴苯是一种化工原料,可以用溴和苯反应合成.实验室合成溴苯的装置示意图如下:

表为苯、溴和溴苯的相关数据,回答下列问题:
在A中加入30.0mL无水苯和少量铁屑.在B中小心加入8.0mL液态溴.向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏.
①A的容积最适合的是c(填编号).
a.25mL b.50mL c.100mL d.250mL
②收集溴苯时,应根据C2(填“C1”或“C2”)所显示的温度,其温度应为156℃.
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,则用它可吸收承接到的所有物质有Br2、HBr、C6H6(填化学名称).
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应.
第一步:取少量反应后F装置中的溶液于试管中;
第二步:向其中加入过量的稀硝酸;
第三步:继续滴加少量的硝酸银溶液.如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应.
该实验方案不合理(填“合理”或“不合理”),理由是溴可以和NaOH溶液反应生成溴离子,也能产生浅黄色沉淀,无法确定是否生成溴化氢,即无法确定两者发生的是取代反应.

| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
在A中加入30.0mL无水苯和少量铁屑.在B中小心加入8.0mL液态溴.向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏.
①A的容积最适合的是c(填编号).
a.25mL b.50mL c.100mL d.250mL
②收集溴苯时,应根据C2(填“C1”或“C2”)所显示的温度,其温度应为156℃.
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,则用它可吸收承接到的所有物质有Br2、HBr、C6H6(填化学名称).
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应.
第一步:取少量反应后F装置中的溶液于试管中;
第二步:向其中加入过量的稀硝酸;
第三步:继续滴加少量的硝酸银溶液.如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应.
该实验方案不合理(填“合理”或“不合理”),理由是溴可以和NaOH溶液反应生成溴离子,也能产生浅黄色沉淀,无法确定是否生成溴化氢,即无法确定两者发生的是取代反应.
 .
.
