题目内容
16.下列说法正确的是( )| A. | 溶液和胶体的本质区别是丁达尔效应 | |
| B. | 液氨、氨水属于纯净物,盐酸和豆浆属于混合物 | |
| C. | 胶体区别于其它分散系的本质特征是粒子大小 | |
| D. | 能进行“交叉分类”的就不能进行“树状分类” |
分析 A.分散系的本质区别在于分散质微粒的直径大小;
B.氨水是氨气的水溶液;
C.分散系的本质区别在于分散质微粒的直径大小;
D.“交叉分类”和“树状分类”可同时进行.
解答 解:A.胶体区别于其它分散系的本质特征是胶体粒子直径在1-100nm(10-7~10-9m)之间,溶液的粒子直径小于1nm,浊液的粒子直径大于100nm,故A错误;
B.氨水是氨气的水溶液,属于混合物,故B错误;
C.胶体区别于其它分散系的本质特征是胶体粒子直径在1-100nm(10-7~10-9m)之间,溶液的粒子直径小于1nm,浊液的粒子直径大于100nm,故C正确;
D.“交叉分类”和“树状分类”分类标准不同,可同时进行,故D错误.
故选C.
点评 本题考查了胶体的性质和本质特征,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.含氮化合物的研发与绿色反展、经济可持续发展有着密切关联.
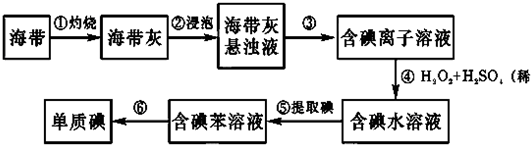
(1)氨是一种重要化工原料.合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如图1所示.
则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+171.1KJ/mol
(2)氮的氧化物有着广泛用途,又是环境的污染物.
(i)在150C时,将0.4mol NO2气体充人体积为2L的真空密闭容器中,发生反应:2NO2(g)-?N2O4(g).
每隔一定时间测定容器内各物质的物质的量,数据如表:
①当反应在1500C达到平衡时,该反应平衡常数K=2.8.(填数值)
②若最初通人N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度应为0.1mol/L.
(ii)氨氧化制HN03的尾气中含有NO和N02,且n(NO):n(N02)=1:1,可用尿素溶液除去,其作用原理是:N0和NO与水反应生成亚硝酸,亚硝酸再与尿素反应生成对环境无污染的物质.若用1mol尿素吸收该尾气,则能吸收氮氧化物76 g.
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)-CO( NH2)2(s)+H2O(g)
图2表示合成塔中氨碳比a与CO2转化率ω的关系.
a为[n(NH3)/n(CO2)],b为水碳比[n(H20)/n(CO2)].则:
①b应控制在C;
A.1.5.1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小.

(1)氨是一种重要化工原料.合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如图1所示.
则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+171.1KJ/mol
(2)氮的氧化物有着广泛用途,又是环境的污染物.
(i)在150C时,将0.4mol NO2气体充人体积为2L的真空密闭容器中,发生反应:2NO2(g)-?N2O4(g).
每隔一定时间测定容器内各物质的物质的量,数据如表:
| 时间 | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
②若最初通人N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度应为0.1mol/L.
(ii)氨氧化制HN03的尾气中含有NO和N02,且n(NO):n(N02)=1:1,可用尿素溶液除去,其作用原理是:N0和NO与水反应生成亚硝酸,亚硝酸再与尿素反应生成对环境无污染的物质.若用1mol尿素吸收该尾气,则能吸收氮氧化物76 g.
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)-CO( NH2)2(s)+H2O(g)
图2表示合成塔中氨碳比a与CO2转化率ω的关系.
a为[n(NH3)/n(CO2)],b为水碳比[n(H20)/n(CO2)].则:
①b应控制在C;
A.1.5.1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小.
19.常温下(25℃),已知H2SO3电离常数Ka1=1.4×10-2,Ka2=6.3×10-4,NH3•H2O的常数Kb=1.8×10-3.则下列有关NH4HSO3溶液的叙述正确的是( )
| A. | 该溶液中,Na+、Cl-、S2-和SO42-可以大量共存 | |
| B. | 含等物质的量的NH4HSO3与NaOH溶液混合,反应的离子方程式为:HSO3-+OH-=SO32-+H2O | |
| C. | NH4HSO3为弱酸弱碱盐,其水溶液pH>7 | |
| D. | c(NH4+)>c(HSO3-)>c(SO32-)>C(H2SO3)>C(NH3•H2O) |
4. 在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
 在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )| A. | a+b<c | |
| B. | 若T2>T1,则该反应在高温下易自发进行 | |
| C. | △H>0 | |
| D. | 若T2<T1,则该反应一定不能自发进行 |
11.已知实验室制备氯气的反应为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,当生成7.1gCl2时,被氧化的HCl的质量是( )
| A. | 3.65g | B. | 7.3g | C. | 10.95g | D. | 14.6g |
5.已知某密闭容器中发生反应:X(g)+Y(g)?2W(g)+Z(g)△H<0 (Y 物质易被液化).下列有关说法中一定正确的是( )
| A. | 若W为有颜色的物质,达平衡后,增大压强,体系颜色变浅 | |
| B. | 改变压强,该反应的平衡常数不变 | |
| C. | 平衡时,其他条件不变,升高温度,正反应速率增大程度比逆反应速率增大程度小 | |
| D. | 平衡时,其他条件不变,分离出 Z,正反应速率加快 |