题目内容
17. KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下:
KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下:(1)第一步,将软锰矿(主要成分为MnO2)和苛性钾混合,在200~270℃下加热熔融并通入空气,可制得绿色的锰酸钾.该反应的离子方程式为2MnO2+4OH-+O2$\frac{\underline{\;熔融\;}}{\;}$2MnO42-+2H2O;
若改用KClO3为氧化剂,则转化可以进行的更快.若转化等量的MnO2,前后两种方法所消耗的氧化剂的物质的量之比为3:2
(2)第二步,锰酸钾可发生反应:3MnO42-+4H+?MnO2+2MnO4-+2H2O
据据此分析可知,调节锰酸钾溶液呈酸性(填“酸性”、“碱性”或“中性”),有利于生成KMnO4.该方法中K2MnO4生成KMnO4理论产率最高为66.7%;.
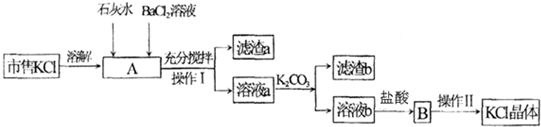
(3)目前生产KMnO4更好的方法是电解锰酸钾溶液法.以特制的Ni电极为阳极,Fe板为阴极,电解锰酸钾溶液,阳极室产生KMnO4.以软锰矿为原料生产高锰酸钾的流程如图:
电解过程发生反应的化学方程式为2K2MnO4+2H2O
 2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).
2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).(4)在化学分析上,KMnO4溶液还经常用于某些物质的定量测定.如测定质量分数约为5%的双氧水的物质的量浓度的实验过程如下:①取5mL 该双氧水溶液稀释到250mL;②再取25mL该稀释液并滴入少量稀硫酸;③用0.020mol/L KMnO4溶液进行滴定,判断达到滴定终点的实验现象是滴入最后一滴高锰酸钾标准溶液,锥形瓶中溶液由无色变为浅紫色,且半分钟内不褪色;④重复操作三次后,消耗KMnO4溶液体积的平均值为14.70mL,则该双氧水的物质的量浓度为1.470mol/L(保留三位小数).
分析 (1)由题给转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数,根据钾元素守恒确定KOH系数,根据氢元素守恒确定H2O系数;根据得失电子守恒计算两种方法所消耗的氧化剂的物质的量之比;
(2)根据化学平衡移动原理分析,当K2MnO4生完全转化为成MnO2和KMnO4时,KMnO4理论产率最高;
(3)根据两极反应书写电解过程发生反应的化学方程式,根据流程图可得出在整个制备流程中可循环利用的物质是氢氧化钾;
(4)高锰酸钾为紫色,当滴定到终点时,H2O2被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为浅紫色,且半分钟内不褪色;根据反应离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,据此计算.
解答 解:(1)由题给转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为2MnO2+4KOH+O2 $\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O,故离子方程式为2MnO2+4OH-+O2$\frac{\underline{\;熔融\;}}{\;}$2MnO42-+2H2O,根据得失电子守恒,都转化1molMnO2时,第一种方法需氧化剂O20.5mol,若用KClO3为,需KClO3氧化剂$\frac{1}{3}$mol,两种方法所消耗的氧化剂的物质的量之比为0.5:$\frac{1}{3}$=3:2;
故答案为:2MnO2+4OH-+O2$\frac{\underline{\;熔融\;}}{\;}$2MnO42-+2H2O;3:2;
(2)根据化学平衡移动原理,要有利于生成KMnO4,应使反应3MnO42-+4H+?MnO2+2MnO4-+2H2O正向移动,则应调节锰酸钾溶液呈酸性,相当于增大H+浓度,平衡正向移动,该方法中当K2MnO4生完全转化为成MnO2和KMnO4时,KMnO4理论产率最高,根据方程式计算为2/3=66.7%,
故答案为:酸性; 66.7%;
(3)由题给信息电解锰酸钾溶液,阳极室产生KMnO4,阴极应为水电离出的氢离子放电生成氢气,根据两极反应书写电解过程发生反应的化学方程式为2K2MnO4+2H2O
故答案为:2K2MnO4+2H2O
(4)高锰酸钾为紫色,当滴定到终点时,H2O2被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为浅紫色,滴定消耗KMnO4的物质的量为14.70×10-3×0.020mol/L=2.94×10-4mol,根据反应离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,25mL双氧水稀释液中含n(H2O2)=$\frac{5}{2}$n(MnO4-)=7.35×10-4mol,则原溶液5mL 双氧水溶液稀释到250mL,含n(H2O2)=7.35×10-4mol×10=7.35×10-3mol,则该双氧水的物质的量浓度为
$\frac{7.35×1{0}^{-3}mol}{0.005L}$=1.470mol/L;
故答案为:滴入最后一滴高锰酸钾标准溶液,锥形瓶中溶液由无色变为浅紫色,且半分钟内不褪色;1.470.
点评 本题考查常见氧化剂与还原剂、氧化还原反应滴定、化学计算和对化学平衡移动原理的应用、阅读题目获取信息的能力等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 直接排放工业废气 | B. | 改进汽车尾气净化技术 | ||
| C. | 采用焚烧方法处理垃圾 | D. | 过度开采和使用化石燃料 |
| A. | 用向上排空气法收集氢气 | |
| B. | 往燃着的酒精灯中添加酒精 | |
| C. | 用丁达尔现象鉴别胶体和溶液 | |
| D. | 稀释浓硫酸时,将水沿器壁慢慢注入酸中 |
| A. | O、S、Na的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次减弱 | ||
| C. | H2CO3的酸性比H3BO3的酸性弱 | D. | Cl-、Br-、I-的还原性依次减弱 |
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 最高正化合价 (或最低负化合价) | -4 | +4 |
(2)含D元素的两种常见共价化合物发生化合反应可生成一种离子化合物,该反应的化学方程式为NH3+HNO3═NH4NO3.
(3)B的单质与D的最高价氧化物对应的水化物在加热条件下发生反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O.
(4)C单质与Al具有某些相似性,比如能与强碱反应,写出C单质与NaOH溶液反应的化学方程式:Si+2NaOH+H2O═Na2SiO3+2H2↑.
(5)A、B、C、D均可形成分子中含18电子的氢化物,这些氢化物的分子式分别为H2S、C2H6、SiH4、N2H4.
| A. |  | B. | 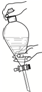 | C. |  | D. | 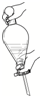 |
| A. | 在负极上发生氧化反应 | B. | 化学性质较活泼的金属为负极 | ||
| C. | 在外电路上电子由负极流向正极 | D. | 是由电能转化为化学能的装置 |