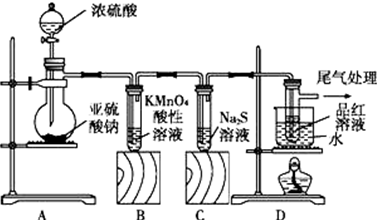
题目内容
8.市售的氯化钾中所含杂质为CaCl2、MgCl2与K2SO4,提纯过程如下(所用试剂均足量):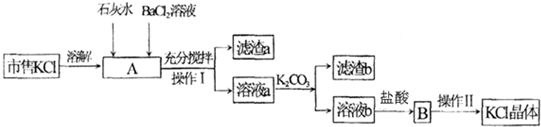
(1)操作Ⅰ的名称是过滤,操作Ⅱ用到的玻璃仪器主要有蒸发皿、玻璃棒、酒精灯、漏斗、烧杯等.
(2)滤渣a的主要成分化学式是Mg(OH)2,BaSO4,对滤渣b高温加热最终能得到两种氧化物.
(3)写出加入石灰水发生的反应方程式Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2.
(4)加K2CO3的作用是沉淀除去钙离子、钡离子.
(5)检验BaCl2溶液是否加入过量,其操作过程为取操作Ⅰ过滤后的滤液少许于试管中,滴加硫酸溶液,若出现白色沉淀说明氯化钡溶液过量,无沉淀生成说明氯化钡未过量.
分析 市售的氯化钾中所含杂质为CaCl2、MgCl2与K2SO4,溶于水后,加入石灰水、氯化钡溶液充分搅拌发生反应,生成氢氧化镁沉淀,硫酸钡沉淀,过滤得到滤渣a为Mg(OH)2,BaSO4,滤液a为CaCl2、KCl溶液,加入碳酸钾反应后过滤得到滤渣b为CaCO3,滤液b中加入盐酸除去碳酸钾得到氯化钾溶液,蒸发浓缩,冷却结晶,过滤洗涤,干燥得到KCl晶体,
(1)操作Ⅰ是分离固体和溶液的实验操作为过滤;操作Ⅱ是蒸发浓缩结晶析出氯化钾晶体,需要的玻璃仪器是蒸发和过滤装置中需要的玻璃仪器;
(2)滤渣a的主要成分Mg(OH)2,BaSO4,滤渣b为CaCO3高温加热最终得到氧化钙和二氧化碳;
(3)加入石灰水和氯化镁反应生成氢氧化镁沉淀;
(4)加入K2CO3的作用是沉淀溶液中钙离子、钡离子生成碳酸钙和碳酸钡沉淀;
(5)取操作Ⅰ过滤后的滤液少许加入硫酸溶液,若出现白色沉淀说明氯化钡溶液过量;
解答 解:市售的氯化钾中所含杂质为CaCl2、MgCl2与K2SO4,溶于水后,加入石灰水、氯化钡溶液充分搅拌发生反应,生成氢氧化镁沉淀,硫酸钡沉淀,过滤得到滤渣a为Mg(OH)2,BaSO4,滤液a为CaCl2、KCl溶液,加入碳酸钾反应后过滤得到滤渣b为CaCO3,滤液b中加入盐酸除去碳酸钾得到氯化钾溶液,蒸发浓缩,冷却结晶,过滤洗涤,干燥得到KCl晶体,
(1)操作Ⅰ是分离固体和溶液的实验操作为过滤;操作Ⅱ是蒸发浓缩结晶析出氯化钾晶体,需要的玻璃仪器是蒸发和过滤装置中需要的玻璃仪器,主要有蒸发皿、玻璃棒、酒精灯、漏斗、烧杯等,
故答案为:过滤;蒸发皿、玻璃棒、酒精灯、漏斗、烧杯等;
(2)滤渣a的主要成分Mg(OH)2,BaSO4,滤渣b为CaCO3高温加热最终得到氧化钙和二氧化碳;
(3)加入石灰水和氯化镁反应生成氢氧化镁沉淀,反应的化学方程式为:Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2,
故答案为:Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;
(4)加入K2CO3的作用是沉淀溶液中钙离子、钡离子生成碳酸钙和碳酸钡沉淀,Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓
故答案为:沉淀除去钙离子、钡离子;
(5)检验BaCl2溶液是否加入过量,其操作过程为:取操作Ⅰ过滤后的滤液少许于试管中,滴加硫酸溶液,若出现白色沉淀说明氯化钡溶液过量,无沉淀生成说明氯化钡未过量,
故答案为:取操作Ⅰ过滤后的滤液少许于试管中,滴加硫酸溶液,若出现白色沉淀说明氯化钡溶液过量,无沉淀生成说明氯化钡未过量;
点评 本题考查了物质分离提纯的过程分析、实验基本操作、主要是离子性质和试剂作用的理解应用,掌握基础是解题关键,题目难度中等.

| A. | 甘油是油脂的一种 | |
| B. | 油脂中均含有酯基 | |
| C. | 油脂不能发生取代反应 | |
| D. | 油脂在酸性条件下的水解程度比碱性条件下大 |
| A. | C6H14 | B. | C7H16 | C. | C8H18 | D. | C9H20 |
| A. | 卤代烃在NaOH的醇溶液中共热均能发生消去反应生成烯烃 | |
| B. | 凡是能发生银镜反应的物质都属于醛类 | |
| C. | 能与FeCl3溶液作用显紫色的有机物一般含有酚羟基 | |
| D. | 酯类水解均能生成含相同碳原子数的羧酸和醇 |
| A. | 是易导电的银白色金属 | B. | Tl(OH)3是两性氢氧化物 | ||
| C. | Tl3+能形成+3价的化合物 | D. | 单质能与稀硝酸反应生成硝酸盐 |

 长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体.甲、乙两位同学发现往水中投入过氧化钙时产生气泡.
长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体.甲、乙两位同学发现往水中投入过氧化钙时产生气泡. KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下:
KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下: 2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).
2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).