题目内容
12.下列实验操作正确的是( )| A. | 用向上排空气法收集氢气 | |
| B. | 往燃着的酒精灯中添加酒精 | |
| C. | 用丁达尔现象鉴别胶体和溶液 | |
| D. | 稀释浓硫酸时,将水沿器壁慢慢注入酸中 |
分析 A.用向上排空气法收集的气体密度大于空气密度;
B.酒精易燃使用时要注意防止发生火灾;
C.胶体具有丁达尔效应而溶液不具备;
D.稀释浓硫酸时要把浓硫酸注入水中;
解答 解:A.氢气密度小于空气密度,应选择向下排空气法收集,故A错误;
B.酒精易燃使用时要注意防止发生火灾,燃着的酒精灯添加酒精易失火,故B错误;
C.胶体和溶液可以用丁达尔现象鉴别,光线通过时胶体出现光亮的通路,溶液无现象,故C正确;
D.稀释浓硫酸时要将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌,防止浓硫酸溶于水放出的热量使液滴飞溅,造成事故,故D错误;
故选:C.
点评 本题为实验题,涉及气体的收集方法选择、仪器的正确使用方法、浓硫酸的稀释操作、物质的鉴别,明确气体的性质,酒精灯的使用方法、胶体的性质,浓硫酸的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
11.下列叙述正确的是( )
| A. | 汽油、柴油和植物油都属于烃 | |
| B. | 淀粉可水解生成葡萄糖,蔗糖可水解生成葡萄糖和果糖 | |
| C. | 苯和溴水在Fe3+催化下发生取代反应生成溴苯 | |
| D. | 硫酸铜溶液和食盐溶液均可使蛋白质溶液变性 |
20.近年来,我国在超导体材料研究方面居于世界领先地位,铊(Tl)是超导体的组成成分之一,铊位于第6周期ⅢA族.下列对铊的性质的推导不正确的是( )
| A. | 是易导电的银白色金属 | B. | Tl(OH)3是两性氢氧化物 | ||
| C. | Tl3+能形成+3价的化合物 | D. | 单质能与稀硝酸反应生成硝酸盐 |
7.NA为阿伏加德罗常数,下列物质所含分子数最少的是( )
| A. | 2 mol N2 | B. | 含NA个分子的Cl2 | ||
| C. | 标准状况下11.2 L的CH4 | D. | 6 g H2 (H2摩尔质量为2 g•mol-1) |
4.一定量的甲烷在O2不足的情况下燃烧,得到CO、CO2和H2O的总质量是14.4g,若其中水的质量是7.2g,则CO的质量是( )
| A. | 2.8 g | B. | 4.4 g | ||
| C. | 5.6 g | D. | 在2.8 g和5.6 g之间 |
1.X、Y、Z、R、M是元素周期表中原子序数依次增大的五种短周期元素,其相关信息如下表:
(1)Y、Z、R的第一电离能从大到小的顺序是N>O>C(填元素符号)
(2)Z、R的最简单氢化物中稳定性强的是H2O,沸点高的是H2O(填化学式)
(3)甲是由上述3种元素组成的常见化合物,常温下pH=3的甲溶液中由水电离c(H+)=10-3mol/L,则甲的化学式是NH4NO3.
(4)直线型分子Y2Z2中所有原子都达到8电子稳定结构,则分子中σ键与π键的个数之比是3:4.
(5)常温下0.58gY4H10完全燃烧放出29kJ的热量,请写出Y4H10燃烧热的热化学方程式C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-2900kJ/mol.
| 元素 | 相关信息 |
| X | X的一种核素的原子核中没有中子 |
| Y | Y原子的核外电子占据4个原子轨道 |
| Z | Z的气态氢化物能使湿润的红色石蕊试纸变蓝 |
| R | R是地壳中含量最高的元素 |
| M | M的单质与冷水剧烈反应,生成的强碱中含有电子数相同的阴阳离子 |
(2)Z、R的最简单氢化物中稳定性强的是H2O,沸点高的是H2O(填化学式)
(3)甲是由上述3种元素组成的常见化合物,常温下pH=3的甲溶液中由水电离c(H+)=10-3mol/L,则甲的化学式是NH4NO3.
(4)直线型分子Y2Z2中所有原子都达到8电子稳定结构,则分子中σ键与π键的个数之比是3:4.
(5)常温下0.58gY4H10完全燃烧放出29kJ的热量,请写出Y4H10燃烧热的热化学方程式C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-2900kJ/mol.
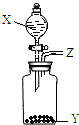 长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体.甲、乙两位同学发现往水中投入过氧化钙时产生气泡.
长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体.甲、乙两位同学发现往水中投入过氧化钙时产生气泡. KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下:
KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下: 2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).
2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).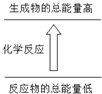 下列变化符合图示的是( )
下列变化符合图示的是( )