题目内容
3.氢化钠(NaH)是一种白色的离子化合物.NaH与水反应放出氢气.下列叙述中正确的是( )| A. | NaH中氢是+1价 | |
| B. | NaH中阴离子半径比锂离子半径小 | |
| C. | NaH中阴离子的电子层排布与氦原子相同 | |
| D. | NaH中阴离子可被还原成氢气 |
分析 A、NaH中H元素是-1价;
B、根据电子层结构相同的离子半径与核电荷数的关系判断;
C、先判断氢离子的电子数,再把其电子层排布与氖原子的比较判断;
D、根据氢化钠和水反应时化合价的变化判断.
解答 解:A、NaH中H元素是-1价,而不是+1价,故A错误;
B、负一价氢离子和锂离子的电子层结构相同,电子层结构相同的离子半径与核电荷数成反比,所以氢离子半径大于锂离子半径,故B错误;
C、NaH中H元素是-1价,其核外电子数为2,所以其电子层排布与氦原子的相同,故C正确;
D、NaH+H2O=H2+NaOH,氢化钠氢离子失电子被氧化生成氢气,故D错误;
故选C.
点评 本题考查了粒子半径大小的比较及盐类的水解,难度不大,根据反应方程式结合题意分析.

练习册系列答案
相关题目
13.下列各组气体制备的发生装置相同的是( )
| A. | O2、H2 | B. | Cl2、HCl | C. | H2、Cl2 | D. | O2、HCl |
14.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)?NH3(g)+HI(g);②2HI(g)?H2(g)+I2(g);③2NH3(g)?N2(g)+3H2(g).
达到平衡时,c(H2)=2mol/L,c(N2)=0.5mol/L,c(HI)=4mol/L,则平衡时 NH3的浓度为( )
①NH4I(s)?NH3(g)+HI(g);②2HI(g)?H2(g)+I2(g);③2NH3(g)?N2(g)+3H2(g).
达到平衡时,c(H2)=2mol/L,c(N2)=0.5mol/L,c(HI)=4mol/L,则平衡时 NH3的浓度为( )
| A. | 0.5 mol•L-1 | B. | 2 mol•L-1 | C. | 4 mol•L-1 | D. | 5 mol•L-1 |
11.下列有关电解质溶液的说法正确的是( )
| A. | 常温下,CH3COONH4溶液的pH=7,说明等温等浓度的CH3COOH和NH3•H2O的电离度相等 | |
| B. | 锅炉中沉积的CaSO4可用稀Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| C. | 向0.1 mol/L的Na2CO3溶液中滴加稀盐酸至中性,溶液中c(CO32-)=c(HCO3-) | |
| D. | 将CH3COONa溶液从20℃升温至30℃,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$减小 |
18.下列离子方程式书写正确的是( )
| A. | 铝粉投入到NaOH溶液中:2Al+2OH -═2 AlO2-+H 2↑ | |
| B. | AlCl 3溶液中加入足量的氨水:Al3++3OH -═Al(OH) 3↓ | |
| C. | 三氯化铁溶液中加入铁粉:Fe 3++Fe═2Fe 2+ | |
| D. | FeCl 2溶液跟Cl 2反应:2Fe 2++Cl 2═2Fe 3++2Cl - |
8.下列化学用语错误的是( )
| A. | 氯化氢分子的电子式: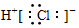 | B. | 乙烯的最简式:CH2 | ||
| C. | 苯的分子式:C6H6 | D. | 氯的原子结构示意图: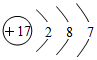 |
15.原子晶体中可能存在的化学键是( )
| A. | 离子键 | B. | 氢键 | C. | 极性键 | D. | 金属键 |
16.把下列4种Na2S2O3的溶液分别加入4个盛有10mL 2mol•L-1硫酸的烧杯中,均加水稀释到50mL,此时,Na2S2O3和硫酸进行反应.其中出现沉淀最快的是( )
| A. | 20mL 3mol•L-1Na2S2O3的溶液 | B. | 20mL 2mol•L-1Na2S2O3的溶液 | ||
| C. | 10mL 4mol•L-1Na2S2O3的溶液 | D. | 10mL 2mol•L-1Na2S2O3的溶液 |