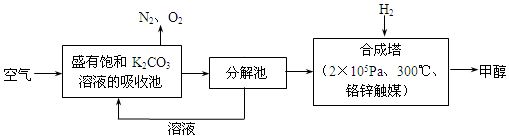
题目内容
11.下列有关电解质溶液的说法正确的是( )| A. | 常温下,CH3COONH4溶液的pH=7,说明等温等浓度的CH3COOH和NH3•H2O的电离度相等 | |
| B. | 锅炉中沉积的CaSO4可用稀Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| C. | 向0.1 mol/L的Na2CO3溶液中滴加稀盐酸至中性,溶液中c(CO32-)=c(HCO3-) | |
| D. | 将CH3COONa溶液从20℃升温至30℃,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$减小 |
分析 A.常温下,CH3COONH4溶液的pH=7,可知醋酸根离子、铵根离子水解程度相同;
B.CaSO4可用饱和Na2CO3溶液浸泡,转化为碳酸钙沉淀;
C.向0.1 mol/L的Na2CO3溶液中滴加稀盐酸至中性,溶质为NaCl;
D.CH3COONa溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{h}}{c({H}^{+})}$,升高温度促进水解,Kh增大,c(H+)减小.
解答 解:A.常温下,CH3COONH4溶液的pH=7,可知醋酸根离子、铵根离子水解程度相同,则等温等浓度的CH3COOH和NH3•H2O的电离度相等,故A正确;
B.CaSO4可用饱和Na2CO3溶液浸泡,转化为碳酸钙沉淀,稀盐酸可溶解除去碳酸钙,故B错误;
C.向0.1 mol/L的Na2CO3溶液中滴加稀盐酸至中性,溶质为NaCl,溶液中不存在溶液中CO32-、HCO3-,故C错误;
D.CH3COONa溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{h}}{c({H}^{+})}$,升高温度促进水解,Kh增大,c(H+)减小,则$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$增大,故D错误;
故选A.
点评 本题考查酸碱混合、盐类水解及沉淀生成,为高频考点,把握水解与电离、沉淀转化及应用等为解答的关键,侧重分析与应用能力的考查,选项B为易错点,题目难度不大.

练习册系列答案
相关题目
1.按下列实验方法不能达到要求的是( )
①用托盘天平称量14.31g NaCl
②用100mL量筒量取4.5mL稀硫酸
③用紫色石蕊试液检验溶液的酸碱性
④用pH试纸测出溶液的pH为5.60.
①用托盘天平称量14.31g NaCl
②用100mL量筒量取4.5mL稀硫酸
③用紫色石蕊试液检验溶液的酸碱性
④用pH试纸测出溶液的pH为5.60.
| A. | ①③ | B. | ②③ | C. | ③④ | D. | ①②④ |
2.有下有机物,请将它所对应的类别用序号填入下列表格中:
(1)CH3CH2CH3 ①酯
(2)CH2=CH-CH3 ②羧酸
(3)CH3COOCH3 ③醛
(4)CH3-CHO ④醇
(5)CH3-OH ⑤烯烃
(6)CH3CH2COOH ⑥烷烃
(1)CH3CH2CH3 ①酯
(2)CH2=CH-CH3 ②羧酸
(3)CH3COOCH3 ③醛
(4)CH3-CHO ④醇
(5)CH3-OH ⑤烯烃
(6)CH3CH2COOH ⑥烷烃
| 物质编号 | 所属类别编号 | 物质编号 | 所属类别编号 |
| (1) | (4) | ||
| (2) | (5) | ||
| (3) | (6) |
19.零价铁(Fe)除去水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.
(1)Fe还原水体中NO3-的反应原理如图所示.的反应原理如图1所示.
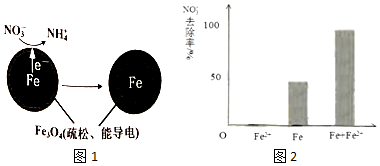
正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如表:
pH=4.5时,NO3-的去除率低.其原因是因为铁表面生成不导电的FeO(OH),将铁全部覆盖,阻止反应进一步发生.
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
对比实验,结果如图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.pH=4.5(其他条件相同)
Ⅱ.高铁酸钠Na2FeO4
(4)高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式为.
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体能够吸附水中悬浮杂质,请写出高铁酸钠与水反应的离子方程式.
(1)Fe还原水体中NO3-的反应原理如图所示.的反应原理如图1所示.

正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
对比实验,结果如图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.pH=4.5(其他条件相同)
Ⅱ.高铁酸钠Na2FeO4
(4)高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式为.
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体能够吸附水中悬浮杂质,请写出高铁酸钠与水反应的离子方程式.
6.25℃时,0.1mol•L-1的某一元弱酸溶液中酸的电离度为a%,则该溶液的pH为( )
| A. | 1 | B. | 1-a | C. | 2-lg a | D. | 3-lg a |
16.下列物质中最简式相同,但既不是同系物,也不是同分异构体,又不含相同官能团的是( )
| A. | CH3CH=CH2和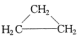 | B. | 乙炔和苯 | C. |  和 和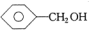 | D. | 乙酸和甲酸甲酯 |
3.氢化钠(NaH)是一种白色的离子化合物.NaH与水反应放出氢气.下列叙述中正确的是( )
| A. | NaH中氢是+1价 | |
| B. | NaH中阴离子半径比锂离子半径小 | |
| C. | NaH中阴离子的电子层排布与氦原子相同 | |
| D. | NaH中阴离子可被还原成氢气 |
4.下列关于金属的一些说法不正确的是( )
| A. | 合金的性质与其成分金属的性质不完全相同 | |
| B. | 工业上金属Mg、Al都是用电解熔融的氯化物制得的 | |
| C. | 黑色的氧化铜灼烧会变成砖红色 | |
| D. | 将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |