题目内容
(1)NaHCO3俗名 .NaHCO3与盐酸反应的离子方程式 .
(2)铝是一种日常生活中应用很广的重要金属,在酒精灯上加热未经打磨的铝箔,出现的现象是 .铝制炊具长时间烧煮碱性食物的过程中,铝的保护膜将被破坏.写出铝的保护膜与碱反应的离子方程式 .
(3)石英、水晶盒玛瑙的主要成分都是SiO2,写出SiO2与强碱反应的离子方程式 .硅胶常用作实验室和袋装食品等的干燥剂,也是良好的催化剂载体,其原因是 .
(4)氯气通入NaOH溶液中可以制得具有高效杀菌、消毒、漂白作用的漂白液,其反应的离子方程式为 .写出实验室制氨气的化学方程式 .
(5)实验室常用KMnO4和浓盐酸在不加热的条件下反应制取Cl2,反应的化学方程式为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.
①被氧化的元素是 ,氧化剂是 .
②将氧化剂和还原剂的化学式及相应的物质的量按先后顺序填入下列方框中,并用单线桥法标出电子转移的方向和数目: .
(2)铝是一种日常生活中应用很广的重要金属,在酒精灯上加热未经打磨的铝箔,出现的现象是
(3)石英、水晶盒玛瑙的主要成分都是SiO2,写出SiO2与强碱反应的离子方程式
(4)氯气通入NaOH溶液中可以制得具有高效杀菌、消毒、漂白作用的漂白液,其反应的离子方程式为
(5)实验室常用KMnO4和浓盐酸在不加热的条件下反应制取Cl2,反应的化学方程式为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.
①被氧化的元素是
②将氧化剂和还原剂的化学式及相应的物质的量按先后顺序填入下列方框中,并用单线桥法标出电子转移的方向和数目:
考点:钠的重要化合物,氧化还原反应,氯气的化学性质,硅和二氧化硅,铝的化学性质
专题:元素及其化合物
分析:(1)碳酸氢钠俗称为小苏打,能够与盐酸反应生成氯化钠和二氧化碳、水;
(2)铝和氧气反应生成了氧化铝,氧化铝的熔点高于铝的熔点,氧化铝膜兜住熔化铝不滴落,氧化铝与氢氧化钠反应生成偏铝酸钠和水;
(3)二氧化硅为酸性氧化物,与氢氧化钠反应生成硅酸钠和水,硅胶内部多孔,吸附水分能力强,常用作吸水剂;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;氯化铵与氢氧化钙在加热条件下反应生成氨气、氯化钙和水;
(5)化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂;依据化合价的变化,判断电子的转移方向和数目.
(2)铝和氧气反应生成了氧化铝,氧化铝的熔点高于铝的熔点,氧化铝膜兜住熔化铝不滴落,氧化铝与氢氧化钠反应生成偏铝酸钠和水;
(3)二氧化硅为酸性氧化物,与氢氧化钠反应生成硅酸钠和水,硅胶内部多孔,吸附水分能力强,常用作吸水剂;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;氯化铵与氢氧化钙在加热条件下反应生成氨气、氯化钙和水;
(5)化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂;依据化合价的变化,判断电子的转移方向和数目.
解答:
解:(1)碳酸氢钠俗称为小苏打,能够与盐酸反应生成氯化钠和二氧化碳、水,离子方程式为:HCO3-+H+=CO2↑+H2O;
故答案为:小苏打;HCO3-+H+=CO2↑+H2O;
(2)铝和氧气反应生成了氧化铝,氧化铝的熔点高于铝的熔点,氧化铝膜兜住熔化铝不滴落,氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
故答案为:铝箔失去光泽,熔化但不滴落 Al2O3+2OH-=2AlO2-+H2O;
(3)二氧化硅为酸性氧化物,与氢氧化钠反应生成硅酸钠和水,反应的离子方程式:SiO2+2OH-=SiO3 2-+H2O;硅胶内部多孔,吸附水分能力强,常用作吸水剂;
故答案为:SiO2+2OH-=SiO3 2-+H2O; 硅胶内部多孔,吸附水分能力强;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;氯化铵与氢氧化钙在加热条件下反应生成氨气、氯化钙和水,化学方程式:Ca(OH)2+2NH4Cl
2CaCl2+2NH3↑+2H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;Ca(OH)2+2NH4Cl
2CaCl2+2NH3↑+2H2O;
(5)KMnO4和浓盐酸发生反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,化合价升高的Cl元素化合价升高被氧化,高锰酸钾中锰元素化合价降低被还原,为氧化剂;
故答案为:Cl,高锰酸钾;
反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,参加反应的16mol盐酸中,只有10mol盐酸被氧化,转移电子为10mol,单线桥表示为: ;
;
故答案为: .
.
故答案为:小苏打;HCO3-+H+=CO2↑+H2O;
(2)铝和氧气反应生成了氧化铝,氧化铝的熔点高于铝的熔点,氧化铝膜兜住熔化铝不滴落,氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
故答案为:铝箔失去光泽,熔化但不滴落 Al2O3+2OH-=2AlO2-+H2O;
(3)二氧化硅为酸性氧化物,与氢氧化钠反应生成硅酸钠和水,反应的离子方程式:SiO2+2OH-=SiO3 2-+H2O;硅胶内部多孔,吸附水分能力强,常用作吸水剂;
故答案为:SiO2+2OH-=SiO3 2-+H2O; 硅胶内部多孔,吸附水分能力强;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;氯化铵与氢氧化钙在加热条件下反应生成氨气、氯化钙和水,化学方程式:Ca(OH)2+2NH4Cl
| ||
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;Ca(OH)2+2NH4Cl
| ||
(5)KMnO4和浓盐酸发生反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,化合价升高的Cl元素化合价升高被氧化,高锰酸钾中锰元素化合价降低被还原,为氧化剂;
故答案为:Cl,高锰酸钾;
反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,参加反应的16mol盐酸中,只有10mol盐酸被氧化,转移电子为10mol,单线桥表示为:
 ;
;故答案为:
 .
.
点评:本题考查离子方程式、化学方程式的书写、氧化还原反应中的基本概念和电子转移知识,明确物质的性质是解题关键,注意氧化还原反应电子转移和表示方法,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列物质中既能跟氢氧化钠反应又能跟盐酸反应的是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 ⑤NaHSO3.
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 ⑤NaHSO3.
| A、③④ | B、②③④⑤ |
| C、①③④ | D、全部 |
下列说法正确的是( )
| A、用光亮洁净的铁丝蘸取某无色溶液,在无色灯焰上灼烧时观察到黄色火焰,则该溶液中一定含Na+,一定不含K+ |
| B、酸、碱中和反应的实质是H+与OH-结合生成水,故酸碱中和反应的离子反应都可用H++OH-=H2O来表示 |
| C、实验室常将硫磺撒在汞的表面,以除去不慎洒落的汞 |
| D、Na2O与Na2O2都能和水反应生成NaOH,所以它们都是碱性氧化物 |
将某些化学知识用图象表示,可以收到直观、简明的效果.下列图象所表示的化学知识中,不正确的是
( )
( )
A、 分散系的分类 |
B、 醋酸稀释 |
C、 向Na2CO3溶液中逐滴滴入盐酸 |
D、 向AlCl3溶液中滴加过量的NaOH溶液 |
下列说法一定正确的是( )
| A、用弱酸的电离平衡常数比较同温同物质的量浓度下强碱弱酸盐溶液的碱性强弱 |
| B、常温下pH=2的盐酸、氯化铵两种溶液中,水的电离程度相同 |
| C、用化学反应平衡常数推断该化学反应的剧烈程度 |
| D、将等体积、等pH的氢氧化钠溶液和氨水溶液分别稀释相同倍数,氨水的pH变化大 |
对于反应A2+3B2?2C来说,以下表示的反应速率最快的是( )
| A、v(B2)=0.8mol?L-1?S-1 |
| B、v(B2)=0.42mol?L-1?S-1 |
| C、v(C)=0.6mol?L-1?S-1 |
| D、v(A2)=0.4mol?L-1?S-1 |
在体积固定的绝热密闭容器中,可逆反应NO2(g)+SO2(g)?NO(g)+SO3(g)△H<0达到平衡状态的标志是( )
| A、NO2、SO2、NO和SO3四种气体的物质的量浓度之比为1:1:1:1 |
| B、生成n molSO2同时有n mol SO3消耗 |
| C、K值不再发生变化 |
| D、密闭容器中气体的密度不再发生变化 |
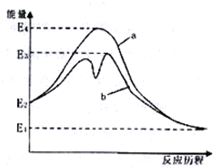 如图表示催化剂对某反应活化能的影响.几种酸的电离常数如下:HClO Kw=2.95×10-8,
如图表示催化剂对某反应活化能的影响.几种酸的电离常数如下:HClO Kw=2.95×10-8,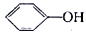 Kw=1.02×10-10H2CO3 Ka1=4.30×10-7 Ka2=5.61×10-11根据图象和数据判断,下列说法错误的是( )
Kw=1.02×10-10H2CO3 Ka1=4.30×10-7 Ka2=5.61×10-11根据图象和数据判断,下列说法错误的是( )| A、图说明了催化剂参与化学反应,并降低了活化能 |
| B、图中该反应没有催化剂参与时活化能为E2-E1 |
| C、将少量CO2通入NaClO溶液中,发生如下反应NaClO+CO2+H2O═HClO+NaHCO 3 |
D、相同浓度的NaClO溶液和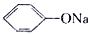 溶液,前者pH小 溶液,前者pH小 |