题目内容
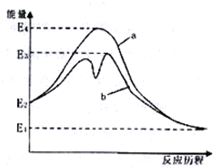 如图表示催化剂对某反应活化能的影响.几种酸的电离常数如下:HClO Kw=2.95×10-8,
如图表示催化剂对某反应活化能的影响.几种酸的电离常数如下:HClO Kw=2.95×10-8,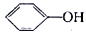 Kw=1.02×10-10H2CO3 Ka1=4.30×10-7 Ka2=5.61×10-11根据图象和数据判断,下列说法错误的是( )
Kw=1.02×10-10H2CO3 Ka1=4.30×10-7 Ka2=5.61×10-11根据图象和数据判断,下列说法错误的是( )| A、图说明了催化剂参与化学反应,并降低了活化能 |
| B、图中该反应没有催化剂参与时活化能为E2-E1 |
| C、将少量CO2通入NaClO溶液中,发生如下反应NaClO+CO2+H2O═HClO+NaHCO 3 |
D、相同浓度的NaClO溶液和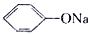 溶液,前者pH小 溶液,前者pH小 |
考点:活化能及其对化学反应速率的影响,弱电解质在水溶液中的电离平衡,探究浓度、催化剂对化学平衡的影响
专题:
分析:A、从图中看出b的活化能小于a的活化能;
B、没有催化剂参与时活化能较大,为E4-E2;
C、碳酸酸性大于次氯酸的酸性,将少量CO2通入NaClO溶液中生成次氯酸钠和碳酸氢钠;
D、强碱弱酸盐溶液浓度相同时,酸性越弱,水解程度越大,碱性越强;
B、没有催化剂参与时活化能较大,为E4-E2;
C、碳酸酸性大于次氯酸的酸性,将少量CO2通入NaClO溶液中生成次氯酸钠和碳酸氢钠;
D、强碱弱酸盐溶液浓度相同时,酸性越弱,水解程度越大,碱性越强;
解答:
解:A、从图中看出b的活化能小于a的活化能,说明了催化剂参与化学反应,并降低了活化能,故A正确;
B、没有催化剂参与时活化能较大,为E4-E2,故B错误
C、碳酸酸性大于次氯酸的酸性,将少量CO2通入NaClO溶液中生成次氯酸钠和碳酸氢钠,发生反应NaClO+CO2+H2O═HClO+NaHCO3,故C正确;
D、强碱弱酸盐溶液浓度相同时,酸性越弱,水解程度越大,碱性越强,PH越大,从电离常数HClO Kw=2.95×10-8, Kw=1.02×10-10看出
Kw=1.02×10-10看出 酸性弱,故D正确;
酸性弱,故D正确;
故选:B.
B、没有催化剂参与时活化能较大,为E4-E2,故B错误
C、碳酸酸性大于次氯酸的酸性,将少量CO2通入NaClO溶液中生成次氯酸钠和碳酸氢钠,发生反应NaClO+CO2+H2O═HClO+NaHCO3,故C正确;
D、强碱弱酸盐溶液浓度相同时,酸性越弱,水解程度越大,碱性越强,PH越大,从电离常数HClO Kw=2.95×10-8,
 Kw=1.02×10-10看出
Kw=1.02×10-10看出 酸性弱,故D正确;
酸性弱,故D正确;故选:B.
点评:本题考查了根据电离常数判断酸的强弱问题和化学反应的活化能的判断,注意影响活化能的因素.

练习册系列答案
相关题目
下列关于溶液中离子浓度的说法正确的是( )
| A、0.1mol.L-1的NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | ||||
B、室温下,将物质的量浓度相等的一元酸HA和KOH等体积混合,溶液的pH=9,则:c(OH-)=c(K+)-c(A-)=
| ||||
C、将HCN和HF溶液混合,达平衡时:c(H+)=
| ||||
| D、等物质的量的CH3COOH和CH3COONa配置成混合溶液,已知其中c(CH3COO-)>c(Na+),则c(CH3COOH)<c(CH3COO-) |
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=-444.3kJ/mol,且熵减小,在常温常压下该反应能自发进行,对反应的方向起决定作用的是( )
| A、焓变 | B、温度 | C、压强 | D、熵变 |
2012年6月24日,“蛟龙”号载人潜入器成功下滑至西太平洋马里亚纳海沟7020米处.同年6月27日,中国“蛟龙”再次刷新“中国深度”-下潜7062米.“蛟龙”号载人潜水器的外壳是耐超高压的钛合金,下面有关合金的说法正确的是( )
| A、钛合金是一种新型金属单质 |
| B、钛合金熔点比成分金属高,且硬度也更大 |
| C、目前人类使用最广泛的金属材料是铝合金 |
| D、青铜、碳素钢、合金钢和硬铝都是合金 |
 如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为( )
如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为( )2PbSO4+2H2O
| 充电 |
| 放电 |
2- 4 |
| A、K与N相接时,能量由电能转化为化学能 |
| B、K与N相接时,H+向负极区迁移 |
| C、K与M连接时,所用电源的a极为负极 |
| D、K与M相接时,阳极附近的pH逐渐增大 |
 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )| A、X、Y、Z中最简单氢化物稳定性最弱的是X |
| B、氧化物对应水化物的酸性Z一定强于Y |
| C、形成的单核阴离子还原性Y强于X |
| D、Z元素单质在化学反应中只表现氧化性,它在水溶液中有漂白性 |
已知反应:
①2K2CrO4+H2SO4═K2Cr2O3+K2SO4+H2O,
②Fe2(SO4)3+2HI═2FeSO4+I2+H2SO4,
③K2Cr2O7+6FeSO4+7H2SO4═3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O.
下列结论不正确的是( )
①2K2CrO4+H2SO4═K2Cr2O3+K2SO4+H2O,
②Fe2(SO4)3+2HI═2FeSO4+I2+H2SO4,
③K2Cr2O7+6FeSO4+7H2SO4═3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O.
下列结论不正确的是( )
| A、①②③均是氧化还原反应 |
| B、氧化性强弱顺序:K2Cr2O7>Fe2(SO4)3>I2 |
| C、反应②中1mol还原剂失去电子数为6.02×1023 |
| D、反应③中氧化剂与还原剂的物质的量之比为1:6 |