题目内容
在体积固定的绝热密闭容器中,可逆反应NO2(g)+SO2(g)?NO(g)+SO3(g)△H<0达到平衡状态的标志是( )
| A、NO2、SO2、NO和SO3四种气体的物质的量浓度之比为1:1:1:1 |
| B、生成n molSO2同时有n mol SO3消耗 |
| C、K值不再发生变化 |
| D、密闭容器中气体的密度不再发生变化 |
考点:化学平衡状态的判断
专题:
分析:可逆反应NO2(g)+SO2(g)=NO(g)+SO3(g)达到平衡,一定满足正反应速率等于逆反应速率,反应体系中各组分的浓度不再变化,据此进行判断.
解答:
解:A、化学反应达到平衡时各物质浓度不变,而不是相等,其物质的量浓度比也不一定等于化学计量数之比,故A错误;
B、生成nmolSO2的同时,有nmol SO3消耗,都指的是逆反应速率,不能说明正逆反应速率相等,故B错误;
C、只要温度不变,化学平衡常数K就不变,正反应放热,在绝热密闭容器中反应,温度不变时反应达到平衡状态,故C正确;
D、该反应为气体体积不变的反应,无论反应是否已达平衡,压强均不变,所以压强不能作为判断平衡状态的依据,故D错误;
故选C.
B、生成nmolSO2的同时,有nmol SO3消耗,都指的是逆反应速率,不能说明正逆反应速率相等,故B错误;
C、只要温度不变,化学平衡常数K就不变,正反应放热,在绝热密闭容器中反应,温度不变时反应达到平衡状态,故C正确;
D、该反应为气体体积不变的反应,无论反应是否已达平衡,压强均不变,所以压强不能作为判断平衡状态的依据,故D错误;
故选C.
点评:本题考查了化学平衡状态的判断,题目难度不大,注意绝热密闭容器中,温度不变反应达到平衡状态.

练习册系列答案
相关题目
某兴趣小组的同学,在配制100ml0.5mol?L-1的Na2CO3溶液时有以下实验操作,其中会导致所配制的溶液浓度偏高的是( )
| A、天平左盘放砝码,右盘放固体 |
| B、容量瓶使用时含有少量的蒸馏水 |
| C、定容时水加多了 |
| D、定容时俯视刻度线 |
在2A(g)+B(g)?3C(g)+4D(g)中,表示该反应速率最快的是( )
| A、v(A)=5.0mol?L-1?min-1 |
| B、v(B)=2.0mol?L-1?min-1 |
| C、v(C)=0.9mol?L-1?s-1 |
| D、v(D)=1.0mol?L-1?s-1 |
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=-444.3kJ/mol,且熵减小,在常温常压下该反应能自发进行,对反应的方向起决定作用的是( )
| A、焓变 | B、温度 | C、压强 | D、熵变 |
 如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为( )
如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为( )2PbSO4+2H2O
| 充电 |
| 放电 |
2- 4 |
| A、K与N相接时,能量由电能转化为化学能 |
| B、K与N相接时,H+向负极区迁移 |
| C、K与M连接时,所用电源的a极为负极 |
| D、K与M相接时,阳极附近的pH逐渐增大 |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| B、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为2NA |
| C、已知某种元素的一种原子的质量为 a g,则该元素的相对原子质量近似为a NA |
| D、78 g苯中含有C═C双键的数目为3NA |
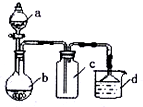 实验室某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质完成相关实验,最合理的选项是( )