题目内容
15.医学药物M的合成路线如下: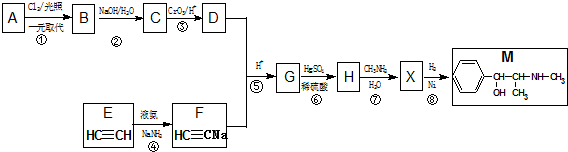
已知以下信息:
①芳香烃A的相对分子质量为92
②R-CH2-OH$\underset{\stackrel{Cr{O}_{3}/{H}^{+}}{→}}{\;}$R-CHO
③R′-C≡CNa+R-CHO$\underset{\stackrel{{H}^{+}}{→}}{\;}$
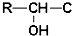 ≡C-R′
≡C-R′④
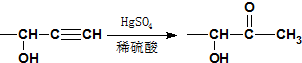
⑤
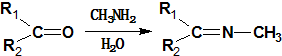
回答下列问题:
(1)A的名称为甲苯,B→C 的反应类型取代反应.
(2)简述检验D中官能团的实验操作在洁净的试管中加入少量新制银氨溶液,再滴入几滴D样品,振荡后把试管放在水浴中加热,一段时间后若看到试管内壁上附着一层光亮的银镜,证明D样品中含有官能团醛基.
(3)G的结构简式是
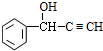 .
.(4)反应⑦的化学方程式为
 +CH3NH2$\stackrel{水}{→}$
+CH3NH2$\stackrel{水}{→}$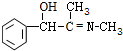 +H2O.
+H2O.(5)H中的官能团名称为羰基、羟基,这些官能团可用光谱法测定,其方法为红外光谱法.
(6)同时满足下列条件的M的同分异构体有12种(不考虑立体异构).
a.遇FeCl3溶液发生显色反应且含有官能团-NH2.
b.苯环上只有2个对位取代基.
其中核磁共振氢谱中有6组峰,且峰面积比为1:2:2:2:2:6,其结构简式为
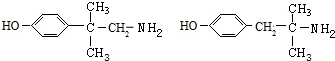 (任写一种).
(任写一种).
分析 某芳香烃A的相对分子质量为92,令分子组成为CxHy,则$\frac{92}{12}$=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故芳香烃A的分子式为C7H8,结构简式为 ,A与氯气发生取代反应生成B,B水解得到C,C能发生信息②中的反应,则B为
,A与氯气发生取代反应生成B,B水解得到C,C能发生信息②中的反应,则B为 ,C为
,C为 ,D为
,D为 ,D与F发生信息③中的反应生成G为
,D与F发生信息③中的反应生成G为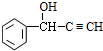 ,G发生信息④中反应生成H为
,G发生信息④中反应生成H为 ,H发生信息⑤中的反应得到X为
,H发生信息⑤中的反应得到X为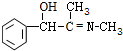 ,再与氢气发生加成反应得到M.
,再与氢气发生加成反应得到M.
解答 解:某芳香烃A的相对分子质量为92,令分子组成为CxHy,则$\frac{92}{12}$=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故芳香烃A的分子式为C7H8,结构简式为 ,A与氯气发生取代反应生成B,B水解得到C,C能发生信息②中的反应,则B为
,A与氯气发生取代反应生成B,B水解得到C,C能发生信息②中的反应,则B为 ,C为
,C为 ,D为
,D为 ,D与F发生信息③中的反应生成G为
,D与F发生信息③中的反应生成G为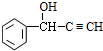 ,G发生信息④中反应生成H为
,G发生信息④中反应生成H为 ,H发生信息⑤中的反应得到X为
,H发生信息⑤中的反应得到X为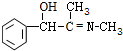 ,再与氢气发生加成反应得到M.
,再与氢气发生加成反应得到M.
(1)A的结构简式为 名称为甲苯,B→C 的反应类型:取代反应,
名称为甲苯,B→C 的反应类型:取代反应,
故答案为:甲苯;取代反应;
(2)D为 ,含有的官能团为醛基,简述检验D中官能团的实验操作:在洁净的试管中加入少量新制银氨溶液,再滴入几滴D样品,振荡后把试管放在水浴中加热,一段时间后若看到试管内壁上附着一层光亮的银镜,证明D样品中含有官能团醛基,
,含有的官能团为醛基,简述检验D中官能团的实验操作:在洁净的试管中加入少量新制银氨溶液,再滴入几滴D样品,振荡后把试管放在水浴中加热,一段时间后若看到试管内壁上附着一层光亮的银镜,证明D样品中含有官能团醛基,
故答案为:在洁净的试管中加入少量新制银氨溶液,再滴入几滴D样品,振荡后把试管放在水浴中加热,一段时间后若看到试管内壁上附着一层光亮的银镜,证明D样品中含有官能团醛基;
(3)G的结构简式是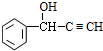 ,
,
故答案为: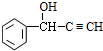 ;
;
(4)反应⑦的化学方程式为: +CH3NH2$\stackrel{水}{→}$
+CH3NH2$\stackrel{水}{→}$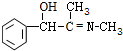 +H2O,
+H2O,
故答案为: +CH3NH2$\stackrel{水}{→}$
+CH3NH2$\stackrel{水}{→}$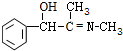 +H2O;
+H2O;
(5)H为 ,含有的官能团名称为:羰基、羟基,这些官能团可用光谱法测定,其方法为红外光谱法,
,含有的官能团名称为:羰基、羟基,这些官能团可用光谱法测定,其方法为红外光谱法,
故答案为:羰基、羟基;红外光谱法;
(6)同时满足下列条件的M的同分异构体:
a.遇FeCl3溶液发生显色反应,则含有酚羟基,且含有官能团-NH2,b.苯环上只有2个对位取代基,可以看做丁烷中两个H原子被-NH2、 取代,正丁烷被取代,
取代,正丁烷被取代, 取代甲基中H原子,则-NH2有4种位置,
取代甲基中H原子,则-NH2有4种位置, 取代亚甲基中H原子,则-NH2有4种位置,异丁烷被取代,
取代亚甲基中H原子,则-NH2有4种位置,异丁烷被取代, 取代甲基中H原子,则-NH2有3种位置,
取代甲基中H原子,则-NH2有3种位置, 取代次甲基中H原子,则-NH2有1种位置,故共有12种,其中核磁共振氢谱中有6组峰,且峰面积比为1:2:2:2:2:6,其结构简式为:
取代次甲基中H原子,则-NH2有1种位置,故共有12种,其中核磁共振氢谱中有6组峰,且峰面积比为1:2:2:2:2:6,其结构简式为: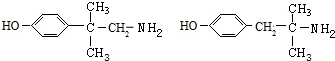 ,
,
故答案为:12;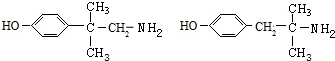 .
.
点评 本题考查有机物的推断,根据A的相对分子质量推断A的结构是解题的关键,理解题目给予信息的理解,是对有机物知识的综合考查,能较好的考查学生的信息获取与迁移应用能力、分析思维能力,是有机热点题型.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| (1) | 0.3mol | 0.2mol | 0.1mol | ╱ |
| (2) | 0.1mol | 0.3mol | ╱ | 0.1mol |
| A. | 各种离子的浓度均相同 | B. | 只有c(K+)相同 | ||
| C. | 各种离子的浓度均不同 | D. | 只有c(Zn2+)相同 |
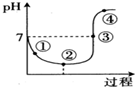 氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:
氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:Cl2(g)?Cl2(aq) K1=10-1.2
Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
25℃时,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,溶液pH变化的曲线如图所示.下列叙述正确的是( )
| A. | 用氯气对水杀菌消毒,夏季要比冬季好 | |
| B. | Cl2(g)+H2O?HClO+H++Cl- K=10-4.6 | |
| C. | 图中点③所示溶液中,c(Na+)=c(Cl-) | |
| D. | 图中点②所示溶液中水的电离程度大于点①所示溶液中水的电离程度 |
| A. | 元素非金属性由强到弱的顺序:Y、X、W | |
| B. | W的简单气态氢化物比Y的简单气态氢化物稳定 | |
| C. | 原子半径由大到小的顺序:Z、Y、X、W | |
| D. | WX与ZX中的化学键类型相同 |
| A. | 制备氢氧化铁胶体:向沸腾的NaOH溶液中,滴加氯化铁饱和溶液,煮沸至红褐色 | |
| B. | 提纯含少量苯酚的苯:加入氢氧化钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验亚硫酸钠是否变质:将试样溶解后加入氯化钡溶液,观察实验现象 | |
| D. | 比较铁与铜的活泼性:将铜粉加入1.0 mol•L-1 Fe2(SO4)3溶液中,观察实验现象 |
 Na2CO3和NaHCO3与盐酸反应热效应的测定.按如图所示连接好装置,为探究NaHCO3、Na2CO3和盐酸反应过程中的热效应,进行实验并测得如下数据:
Na2CO3和NaHCO3与盐酸反应热效应的测定.按如图所示连接好装置,为探究NaHCO3、Na2CO3和盐酸反应过程中的热效应,进行实验并测得如下数据:| 序号 | 48mL试剂 | 固体 | 混合前温度/℃ | 混合后温度/℃ |
| ① | 水 | 2 g NaHCO3 | 20.0 | 18.6 |
| ② | 水 | 2 g Na2CO3 | 20.0 | 21.6 |
| ③ | 盐酸(0.1mol•L-1) | 2 g NaHCO3 | 20.0 | 17.2 |
| ④ | 盐酸(0.1mol•L-1) | 2 g Na2CO3 | 20.0 | 22.6 |
A.NaHCO3(s)的溶解是放热过程
B.Na2CO3(s)的溶解是吸热过程
C.Na2CO3(s)与盐酸的反应是放热反应
D.仅根据实验③就可以确定HCO3-(aq)+H+(aq)═CO2(g)+H2O(l)△H>0.