题目内容
6. Na2CO3和NaHCO3与盐酸反应热效应的测定.按如图所示连接好装置,为探究NaHCO3、Na2CO3和盐酸反应过程中的热效应,进行实验并测得如下数据:
Na2CO3和NaHCO3与盐酸反应热效应的测定.按如图所示连接好装置,为探究NaHCO3、Na2CO3和盐酸反应过程中的热效应,进行实验并测得如下数据:| 序号 | 48mL试剂 | 固体 | 混合前温度/℃ | 混合后温度/℃ |
| ① | 水 | 2 g NaHCO3 | 20.0 | 18.6 |
| ② | 水 | 2 g Na2CO3 | 20.0 | 21.6 |
| ③ | 盐酸(0.1mol•L-1) | 2 g NaHCO3 | 20.0 | 17.2 |
| ④ | 盐酸(0.1mol•L-1) | 2 g Na2CO3 | 20.0 | 22.6 |
A.NaHCO3(s)的溶解是放热过程
B.Na2CO3(s)的溶解是吸热过程
C.Na2CO3(s)与盐酸的反应是放热反应
D.仅根据实验③就可以确定HCO3-(aq)+H+(aq)═CO2(g)+H2O(l)△H>0.
分析 (1)A.根据实验①可知碳酸氢钠溶于水的过程为吸热过程;
B.根据实验②可知碳酸钠的溶解过程为放热过程;
C.根据实验②③可知碳酸钠与盐酸的反应为放热反应;
D.由于碳酸氢钠溶于水的过程为吸热反应,不能仅通过实验③判断碳酸氢钠与盐酸的反应为吸热反应.
解答 解:(1)A.根据实验①可知,碳酸氢钠溶液后,温度从而20.0℃变为18.6℃,说明该过程为吸热过程,故A错误;
B.根据实验②可知,碳酸钠溶于水后温度从20.0℃变为21.6℃,温度升高,说明该过程为放热过程,故B错误;
C.实验②碳酸钠溶于水,混合液温度从20℃升高到21.6℃,实验④中碳酸钠与盐酸反应,温度从20℃升高到22.6℃>21.6℃,碳酸钠与盐酸反应后混合液的温度比碳酸钠溶于水后升高的温度更高,证明碳酸钠与盐酸的反应为放热反应,故C正确;
D.根据表中数据可知,碳酸氢钠溶于水为吸热反应,不能仅根据实验③混合后溶液温度降低而判断碳酸氢钠与盐酸的反应为吸热反应,需要结合实验①综合判断,故D错误;
故选C.
点评 本题考查了探究吸热反应与放热反应,题目难度不大,明确化学反应及其能力变化的关系为解答关键,D为易错点,注意需要考虑碳酸氢钠溶于水引起的能量变化,试题培养了学生的化学实验能力.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
14.化学与生活密切相关,下列说法正确的是( )
| A. | 变性蛋白质不能食用 | |
| B. | 可用甲醛浸泡海鲜 | |
| C. | SO2可以用来增白食品 | |
| D. | “地沟油”禁止食用,但可以用来制肥皂 |
12.化学在工农业生产和日常生活中都有重要应用.下列叙述正确的是( )
| A. | 葡萄糖和蛋白质等高分子化合物是人体必需的营养物质 | |
| B. | 自来水厂用明矾净水,也可以用ClO2代替 | |
| C. | 居室中放置一盆石灰水可以吸收CO,预防中毒 | |
| D. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 |
11.下列有机化学方程式书写正确的是( )
| A. | CH4+Cl2 $\stackrel{光照}{→}$CH2Cl2+H2 | |
| B. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$2CH3CHO+H2O | |
| C. | CH3CH2OH+CH3COOH $\stackrel{浓硫酸}{→}$CH3COOCH2CH3 | |
| D. | H2C═CH2+Br2→CH3CHBr2 |
18.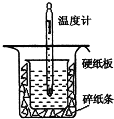 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从如图实验装置看,其中尚缺少的一种玻璃用品是环形玻璃搅拌棒,除此之外,装置中的一个明显错误是小烧杯口未用硬纸板盖住(或大烧杯内碎纸条塞少了,未将小烧杯垫的足够高)
(2)图中的小烧杯应该选择下列哪种规格的②(选填代号)
①50mL ②100mL ③150mL ④250mL
(3)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如下原始数据:
已知盐酸、NaOH溶液密度均近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g•℃),则该反应的中和热△H=-56.8kJ/mol(保留到小数点后1位)
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:(1)从如图实验装置看,其中尚缺少的一种玻璃用品是环形玻璃搅拌棒,除此之外,装置中的一个明显错误是小烧杯口未用硬纸板盖住(或大烧杯内碎纸条塞少了,未将小烧杯垫的足够高)
(2)图中的小烧杯应该选择下列哪种规格的②(选填代号)
①50mL ②100mL ③150mL ④250mL
(3)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如下原始数据:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
15. 海水中主要离子的含量如下:
海水中主要离子的含量如下:
(1)常温下,海水的pH在7.5~8.6之间,其原因是(用离子方程式表示)HCO3-+H2O?H2CO3+OH-.
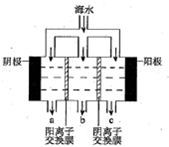
(2)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有Mg(OH)2和CaCO3,生成CaCO3的离子方程式是Ca2++OH-+HCO3-=CaCO3↓+H2O.
(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:
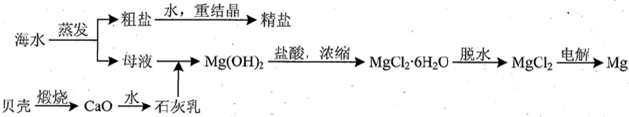
①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是bd.
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2•6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是溶液表面形成晶膜.
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L.
①饱和Mg(OH)2溶液中滴加酚酞,现象是溶液变红.
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量盐酸,再加入足量NaOH,将Mg2+转为Mg(OH)2.25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比,相对误差约为-5.6%[保留2位小数,海水中饱和Mg(OH)2溶液的密度都以l g/cm3计].
 海水中主要离子的含量如下:
海水中主要离子的含量如下:| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
(2)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有Mg(OH)2和CaCO3,生成CaCO3的离子方程式是Ca2++OH-+HCO3-=CaCO3↓+H2O.
(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:

①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是bd.
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2•6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是溶液表面形成晶膜.
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L.
①饱和Mg(OH)2溶液中滴加酚酞,现象是溶液变红.
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量盐酸,再加入足量NaOH,将Mg2+转为Mg(OH)2.25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比,相对误差约为-5.6%[保留2位小数,海水中饱和Mg(OH)2溶液的密度都以l g/cm3计].
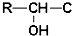 ≡C-R′
≡C-R′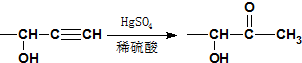
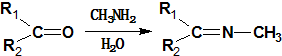
 .
. +CH3NH2$\stackrel{水}{→}$
+CH3NH2$\stackrel{水}{→}$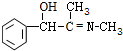 +H2O.
+H2O.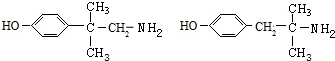 (任写一种).
(任写一种).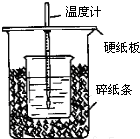 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: