题目内容
7.下列设计的实验方案能达到实验目的是( )| A. | 制备氢氧化铁胶体:向沸腾的NaOH溶液中,滴加氯化铁饱和溶液,煮沸至红褐色 | |
| B. | 提纯含少量苯酚的苯:加入氢氧化钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验亚硫酸钠是否变质:将试样溶解后加入氯化钡溶液,观察实验现象 | |
| D. | 比较铁与铜的活泼性:将铜粉加入1.0 mol•L-1 Fe2(SO4)3溶液中,观察实验现象 |
分析 A.实验室制备氢氧化铁胶体的方法为:向沸水中滴加饱和氯化铁溶液加热到红褐色;
B.苯和苯酚互溶,混合物中加入NaOH溶液,生成苯酚钠,溶于水,但苯不溶于水,可用分液的方法分离;
C.亚硫酸钡和硫酸钡都是白色沉淀;
D.Cu和Fe3+发生氧化还原反应生成Fe2+和Cu2+.
解答 解:A.向氢氧化钠溶液中滴加氯化铁饱和溶液,生成氢氧化铁沉淀,故A错误;
B.苯中混有苯酚,加入NaOH后生成可溶于水的苯酚钠,但苯不溶于水,可用分液的方法分离,故B正确;
C.亚硫酸钡和硫酸钡都是白色沉淀,无法检验,故C错误;
D.比较活泼性应用二价铁离子,Cu和Fe3+发生氧化还原反应生成Fe2+和Cu2+,无法比较,故D错误.
故选B.
点评 本题考查较为综合,涉及物质的分离和制备以及性质等,综合考查学生的分析能力、实验能力和评价能力,为高考常见题型,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.研究发现,腐蚀严重的青铜器表面大都存在CuCl.关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是( )
| A. | 降低了反应的活化能 | B. | 增大了反应物、生成物的能量 | ||
| C. | 降低了反应的焓变 | D. | 增大了反应的平衡常数 |
18.根据如图回答,下列说法不正确的是( )
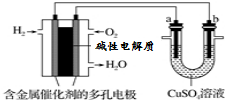

| A. | 此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 | |
| B. | 若a为纯铜,b为粗铜,该装置可用于粗铜的电解精炼 | |
| C. | 燃料电池中正极反应为O2+4e-+2H2O=4OH- | |
| D. | 电子经导线流入b电极 |
2.下列实验操作正确的是( )
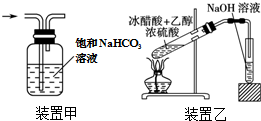

| A. | 将25.0gCuSO4•5H2O溶于100mL蒸馏水,配得1.0mol•L-1硫酸铜溶液 | |
| B. | 焰色反应实验中,在蘸取待测溶液前,先用稀盐酸洗净铂丝并灼烧至火焰为无色 | |
| C. | 用装置甲除去Cl2中的HCl气体 | |
| D. | 用装置乙制取乙酸乙酯 |
12.化学在工农业生产和日常生活中都有重要应用.下列叙述正确的是( )
| A. | 葡萄糖和蛋白质等高分子化合物是人体必需的营养物质 | |
| B. | 自来水厂用明矾净水,也可以用ClO2代替 | |
| C. | 居室中放置一盆石灰水可以吸收CO,预防中毒 | |
| D. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 |
18.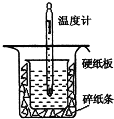 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从如图实验装置看,其中尚缺少的一种玻璃用品是环形玻璃搅拌棒,除此之外,装置中的一个明显错误是小烧杯口未用硬纸板盖住(或大烧杯内碎纸条塞少了,未将小烧杯垫的足够高)
(2)图中的小烧杯应该选择下列哪种规格的②(选填代号)
①50mL ②100mL ③150mL ④250mL
(3)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如下原始数据:
已知盐酸、NaOH溶液密度均近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g•℃),则该反应的中和热△H=-56.8kJ/mol(保留到小数点后1位)
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:(1)从如图实验装置看,其中尚缺少的一种玻璃用品是环形玻璃搅拌棒,除此之外,装置中的一个明显错误是小烧杯口未用硬纸板盖住(或大烧杯内碎纸条塞少了,未将小烧杯垫的足够高)
(2)图中的小烧杯应该选择下列哪种规格的②(选填代号)
①50mL ②100mL ③150mL ④250mL
(3)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如下原始数据:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
19.硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题.
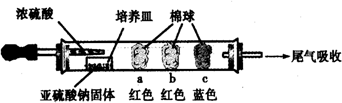
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.请填写表中的空白:
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验.下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置.
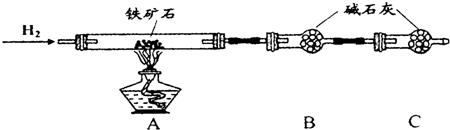
实验一:铁矿石中含氧量的测定
(1)按图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为24%.
实验二:铁矿石中含铁量的测定
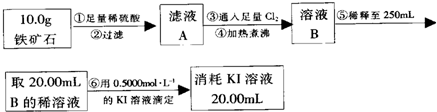
(1)步骤②和⑤中都要用到的玻璃仪器是烧杯、玻璃棒.
(2)下列有关步骤⑥的操作中说法不正确的是bc.
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为Fe5O6.
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.请填写表中的空白:

| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | SO2具有漂白性,且为暂时性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 该气体具有还原性 (选填“氧化性”或“还原性”) |

实验一:铁矿石中含氧量的测定
(1)按图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为24%.
实验二:铁矿石中含铁量的测定

(1)步骤②和⑤中都要用到的玻璃仪器是烧杯、玻璃棒.
(2)下列有关步骤⑥的操作中说法不正确的是bc.
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为Fe5O6.
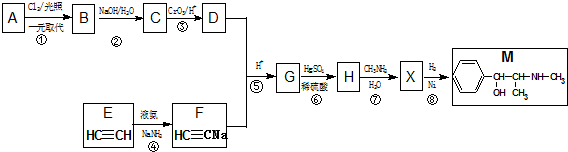
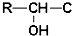 ≡C-R′
≡C-R′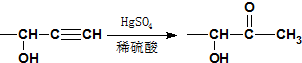
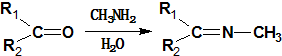
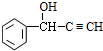 .
. +CH3NH2$\stackrel{水}{→}$
+CH3NH2$\stackrel{水}{→}$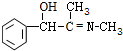 +H2O.
+H2O.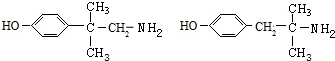 (任写一种).
(任写一种).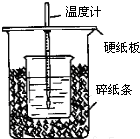 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: