题目内容
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-(aq)+5H2C2O4(aq)+6H+(aq)=2Mn2+(aq)+10CO2(g)+8H2O(l)△H<0.一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化,所用注射器的容积充裕):
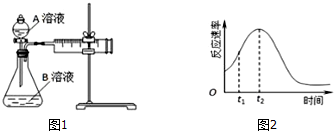
(1)该实验探究的是因素对化学反应速率的影响,如果实验完成时草酸与KMnO4均有剩余,则相同时间内针筒中所得CO2体积大小关系是: <(填实验序号).
(2)研究发现反应速率总是如图2所示发生变化,t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,② .
(3)若实验①在4min末收集了4.48mL CO2(标准状况),则4min末c(MnO4-)=mol?L-1 (假设溶液混合后体积为50mL).
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定 来比较化学反应速率.

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
| ② | 20mL 0.2mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
(2)研究发现反应速率总是如图2所示发生变化,t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,②
(3)若实验①在4min末收集了4.48mL CO2(标准状况),则4min末c(MnO4-)=mol?L-1
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定
考点:浓度、温度、催化剂对化学反应速率的影响
专题:
分析:(1)对比①②实验可探究草酸浓度对化学反应速率的影响,②中A溶液的浓度比①中大;
(2)根据反应中除了催化剂影响反应速率外,还可能是反应过程中放出的热量导致反应速率加快;
(3)先求出反应的n(MnO4-)的物质的量,再求出反应后的浓度;根据v=
计算出4min内的平均速率为v(H2C2O4);
(4)通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.
(2)根据反应中除了催化剂影响反应速率外,还可能是反应过程中放出的热量导致反应速率加快;
(3)先求出反应的n(MnO4-)的物质的量,再求出反应后的浓度;根据v=
| △C |
| △t |
(4)通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.
解答:
解:(1)对比①②实验可探究草酸的浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,所得CO2的体积大,
故答案为:①<②;
(2)研究发现反应速率总是如图2所示发生变化,则t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,有可能为:②该反应为放热反应,反应放出的热量使环境温度升高,加快了反应速率,
故答案为:反应放出的热量使环境温度升高,加速反应;
(3)CO2的物质的量为:
=0.0002mol,设2min末,反应消耗的n(MnO4-)为x,
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
x 0.0002mol
解得 x=0.00004mol
反应剩余的高锰酸根离子的物质的量为:30×10-3L×0.01mol?L-1-0.00004mol=0.00026mol
c(MnO4-)=
=
=5.2×10-3mol/L;
故答案为:5.2×10-3;
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率,
故答案为:KMnO4溶液完全褪色所需时间(或产生相同体积气体所需的时间).
故答案为:①<②;
(2)研究发现反应速率总是如图2所示发生变化,则t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,有可能为:②该反应为放热反应,反应放出的热量使环境温度升高,加快了反应速率,
故答案为:反应放出的热量使环境温度升高,加速反应;
(3)CO2的物质的量为:
| 4.48×10-3L |
| 22.4L/mol |
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
x 0.0002mol
解得 x=0.00004mol
反应剩余的高锰酸根离子的物质的量为:30×10-3L×0.01mol?L-1-0.00004mol=0.00026mol
c(MnO4-)=
| n |
| V |
| 0.00026mol |
| 0.05L |
故答案为:5.2×10-3;
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率,
故答案为:KMnO4溶液完全褪色所需时间(或产生相同体积气体所需的时间).
点评:本题考查了影响化学反应速率的因素,难度中等,注意掌握影响化学反应速率的因素,明确探究影响化学反应速率因素的方法.

练习册系列答案
相关题目
不能说明CH3COOH是弱酸的事实是( )
| A、醋酸钠溶液显碱性 |
| B、10mLpH=2的醋酸溶液加水稀释到100mLpH<3 |
| C、中和10mL0.1mol?L-1醋酸溶液,需要消耗0.1mol?L-1氢氧化钠溶液10mL |
| D、0.1 mol?L-1的醋酸溶液中,氢离子浓度约为0.001 mol?L-1 |
下列物质,属于强电解质的是( )
| A、NH3?H2O |
| B、H2O |
| C、CH3COONH4 |
| D、CH3COOH |
在配制一定物质的量浓度的NaOH溶液时,下列仪器肯定不需要的是( )
A、 |
B、 |
C、 |
D、 |
 如图所示的装置在实验室中用途比较广泛:
如图所示的装置在实验室中用途比较广泛: