题目内容
15.NA表示阿伏伽德罗常数,下列叙述正确的是( )| A. | 250 mL 1 mol•L-1FeCl3溶液中,阴、阳离子总数为NA | |
| B. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 0.1mol HCN分子中含有的π键数目为0.2NA |
分析 A.三价铁离子在水溶液中会水解;
B.氢氧化钠溶液中,氢氧根离子抑制了水的电离,溶液中的氢离子是水电离的,则水电离的氢氧根离子浓度=氢离子浓度=1×10-13mol/L;
C.1个氧气分子得到4个电子生成二价氧;
D.HCN的结构式为H-C≡N.
解答 解:A.1 mol铁离子会水解,生成3mol的氢离子,所以250mL1mol•L-1FeCl3溶液中,阴、阳离子总数大于阿伏加德罗常数,故A错误;
B.在氢氧化钠溶液中,水的电离被抑制,溶液中的氢离子全部来自于水的电离,而在pH=13的氢氧化钠溶液中,氢离子浓度为10-13mol/L,故此溶液中水电离出的氢离子的物质的量为10-13mol,而水电离出的氢氧根的个数等于其电离出的氢离子的个数,故此溶液中水电离出的氢氧根的个数为10-13NA,故B错误;
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA,故C错误;
D.HCN的结构式为H-C≡N,故1molHCN中含2molπ键,故0.1molHCN中含0.2NA条π键,故D正确;
故选D.
点评 本题考查了盐类水解、水的电离及其影响、原电池原理、分子结构等,题目难度中等,明确酸碱溶液抑制了水的电离,能够水解的盐促进了水的电离为解答关键,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
6.等体积等物质的量浓度的①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3混合溶液中,下列各项排序正确的是( )
| A. | pH:②>③>④>① | B. | c(CH3COO-):②>④>③>① | ||
| C. | 溶液中c(H+):①>③>②>④ | D. | c(CH3COOH):①>④>③>② |
6.下列叙述的有机物分子中不含有官能团的是( )
| A. | 乙烯与氢气反应后的产物 | |
| B. | 甲苯与浓硫酸、浓硝酸60℃加热后生成的有机物 | |
| C. | 苯与液溴、还原铁粉混合后生成的有机物 | |
| D. | 甘油 |
3.下列有关叙述不正确的是( )
| A. | 一个D2O分子中所含中子数为8 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<HNO3 | D. | 碱性强弱:KOH>NaOH>Mg(OH)2 |
10.A原子示意图为 ,则x、y及该原子3p能级上的电子数分别为( )
,则x、y及该原子3p能级上的电子数分别为( )
 ,则x、y及该原子3p能级上的电子数分别为( )
,则x、y及该原子3p能级上的电子数分别为( )| A. | 18、6、4 | B. | 22、8、6 | C. | 26、14、6 | D. | 15、3、1 |
20.我国鼓励沿海省市建设海洋强省.下列说法不正确的是( )
| A. | 从海带中提取碘单质的过程涉及氧化还原反应 | |
| B. | 往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输 | |
| C. | 赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的 | |
| D. | 从海水中获得食盐和淡水必须经过化学反应 |
7.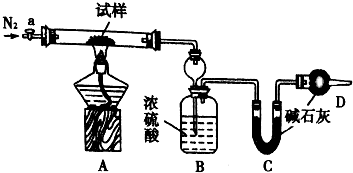 小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•l0H2O,为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如图装置进行实验.
小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•l0H2O,为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如图装置进行实验.
实验过程:
I.按图组装仪器,检查装置的气密性;
II.将m1 g试样放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3 g;
Ⅲ,关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;Ⅳ.称得装置B的质量为m4g、装置C的质量为m5g.
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;Na2CO3•10H2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+10H2O.
(2)装置B的作用为吸收反应生成的水蒸气.装置C的作用为吸收反应生成的二氧化碳.
(3)实验过程中通入N2的目的为使装置中的二氧化碳和水蒸气全部排出被装置BC全部吸收.
(4)用下列各项所提供的数据能计算出NaHCO3的质量分数w(NaHCO3)的是bce(填选项字母)
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3),若能,则w(NaHCO3)的计算式为:$\frac{42({m}_{5}-{m}_{3})}{11{m}_{1}}$×100%(若不能,此问不作答.)
 小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•l0H2O,为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如图装置进行实验.
小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•l0H2O,为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如图装置进行实验.实验过程:
I.按图组装仪器,检查装置的气密性;
II.将m1 g试样放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3 g;
Ⅲ,关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;Ⅳ.称得装置B的质量为m4g、装置C的质量为m5g.
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;Na2CO3•10H2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+10H2O.
(2)装置B的作用为吸收反应生成的水蒸气.装置C的作用为吸收反应生成的二氧化碳.
(3)实验过程中通入N2的目的为使装置中的二氧化碳和水蒸气全部排出被装置BC全部吸收.
(4)用下列各项所提供的数据能计算出NaHCO3的质量分数w(NaHCO3)的是bce(填选项字母)
| 序号 | a | b | c | d | e |
| 数据 | m1、m2、m3 | m2、m3、m4、m5 | m1、m2、m4 | m1、m4、m5 | m1、m3、m5 |
4.下列化学反应属于吸热反应的是( )
| A. | 盐酸与烧碱溶液的反应 | B. | Al与稀盐酸的反应 | ||
| C. | C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO | D. | 葡萄糖在人体内氧化分解 |
5.25℃时,几种弱酸的电离常数如下:
25℃时,下列说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7K2=7.l×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | CH3COONa溶液中,其水解平衡常数K=Kw×10-5 | |
| C. | NaHS 和 Na2S混合溶液中,存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 某浓度NaCN的水溶液pH=d,则其中c(OH-)=10-d mol•L-1 |