题目内容
2.常温下钠与水可以剧烈反应,钠的密度比水小,熔点比较低,融化成光亮的小球是由于钠与水反应是放热反应,而且钠的熔点低在水面上四处游动并发出嘶嘶的响声是由于钠立即与水剧烈反应,并有氢气产生,同时H2燃烧发出嘶嘶声,向反应后的溶液滴加酚酞,溶液会变红,原因请用方程式解释2Na+2H2O=2NaOH+H2↑.分析 钠的密度小于水,熔点低,与水剧烈反应生成氢氧化钠和氢气同时放出大量热,现象总结为:浮水面、熔小球、乱游动、嘶嘶响,加入酚酞溶液变红.
解答 解:钠的密度比水小,熔点比较低,钠与水反应是放热反应,而且钠的熔点低,钠和水反应生成NaOH和氢气,生成的氢气使钠受力不均导致钠四处游动,H2燃烧时发出的咝咝声,钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,故答案为:小;低;钠与水反应是放热反应,而且钠的熔点低;钠立即与水剧烈反应,并有氢气产生,同时H2燃烧发出嘶嘶声;2Na+2H2O=2NaOH+H2↑.
点评 本题以钠和水反应为载体考查钠的性质,明确钠和水反应产生现象的原因,会根据实验现象写出相应的方程式,难点是化学用语的正确运用,为易错点.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
12.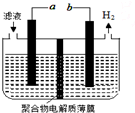 某研究小组利用电化学方法处理石油炼制过程中产生的含H2S的废气.基本工艺是将H2S通入FeCl3溶液中,过滤后将滤液加入如图所示电解槽中电解,电解后的滤液可以循环利用.下列有关说法正确的是( )
某研究小组利用电化学方法处理石油炼制过程中产生的含H2S的废气.基本工艺是将H2S通入FeCl3溶液中,过滤后将滤液加入如图所示电解槽中电解,电解后的滤液可以循环利用.下列有关说法正确的是( )
 某研究小组利用电化学方法处理石油炼制过程中产生的含H2S的废气.基本工艺是将H2S通入FeCl3溶液中,过滤后将滤液加入如图所示电解槽中电解,电解后的滤液可以循环利用.下列有关说法正确的是( )
某研究小组利用电化学方法处理石油炼制过程中产生的含H2S的废气.基本工艺是将H2S通入FeCl3溶液中,过滤后将滤液加入如图所示电解槽中电解,电解后的滤液可以循环利用.下列有关说法正确的是( )| A. | 过滤得到的沉淀可能是FeS | |
| B. | 与a极相连的电极反应式为Fe2+-e-═Fe3+ | |
| C. | 可以用Fe与外接电源的a极相连 | |
| D. | 若有0.1mol电子发生转移,则一定能得到1.12LH2 |
13.下列物质可以用铝制容器存放的是( )
| A. | 浓硝酸 | B. | 稀硫酸 | C. | 浓盐酸 | D. | 浓氢氧化钠溶液 |
10.下列事实中不能用平衡移动原理解释的是( )
| A. | 密闭、低温是存放氨水的必要条件 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 硫酸工业生产中,使用过量空气以提高SO2的利用率 | |
| D. | 合成氨反应采用催化剂以提高氨气的生产效率 |
17.将适量的Cl2通入溴化钠溶液中,等反应停止后,实验室从该溶液中提取溴通常所需的主要仪器和方法是( )
| A. | 蒸发皿;蒸发后灼烧 | |
| B. | 烧杯;冷却、结晶、过滤 | |
| C. | 分液漏斗;分液 | |
| D. | 分液漏斗;加萃取剂,振荡静置后分液 |
7.下列情况不能用勒夏特列原理解释的是( )
| A. | 利用饱和NaCl溶液除去Cl2中的HCl | |
| B. | 乙酸乙酯在碱性条件下水解更充分 | |
| C. | 工业合成氨反应:N2(g)+3H2(g)?2NH3 (g)△H=-92.4kJ/mol,采用较高的温度下进行 | |
| D. | 接触法制硫酸工业中通入过量空气与SO2反应 |
12.已知Fe3O4可表示为(FeO•Fe2O3),水热法制备Fe3O4纳米颗粒的总反应的离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,下列说法正确的是( )
| A. | O2和S2O32-是氧化剂,Fe2+是还原剂 | |
| B. | 每生成1 mol Fe3O4,转移2 mol电子 | |
| C. | 若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol | |
| D. | 参加反应的氧化剂与还原剂的物质的量之比为1:5 |