题目内容
14.下列物质分类组合正确的是( )| A | B | C | D | |
| 强电解质 | CaCO3 | FeCl3 | H2SO4 | NaOH |
| 弱电解质 | HF | CH3COOH | BaSO4 | Na2S |
| 非电解质 | CH4 | Cu | H2O | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
分析 强电解质是指在水溶液或熔化状态下完全电离成离子的化合物;弱电解质是指在溶液中不完全电离,只有部分电离的化合物;非电解质是指在水溶液里或熔融状态下都不导电的化合物;单质、混合物,既不是电解质也不是非电解质,据此分析即可解答.
解答 解:A.CaCO3在水溶液中虽难溶,但溶于水的部分或熔化状态下能完全电离,CaCO3═Ca2++CO32-有自由移动的离子能导电,是强电解质;HF?H++F-,HF只有部分电离是弱电解质,CCl4只存在分子,在水溶液里或熔融状态下都不导电,是非电解质,故A正确;
B.Cu是金属单质,既不是电解质也不是非电解质,故B错误;
C.H2SO4在水中完全电离,所以属于强电解质;BaSO4在水溶液中虽难溶,但溶于水的部分或熔融状态下能完全电离,BaSO4═Ba2++SO42-所以属于强电解质,H2O?H++OH-只有部分电离,所以属于弱电解质,故C错误;
D.Na2S在水溶液或熔化状态下完全电离,是强电解质,故D错误;
故选A.
点评 本题考查了强电解质、弱电解质和非电解质的判断,明确电解质的强弱与电离程度有关是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
4.下列物质之间的转化都能一步能实现的是( )
| A. | N2→NH3→NO→NO2→HNO3→NO | B. | Si→SiO2→H2SiO3→Na2SiO3 | ||
| C. | S→SO3→H2SO4→SO2 | D. | Al→Al2O3→Al(OH)3→NaAlO2 |
9.下列说法正确的是( )
| A. | 按系统命名法,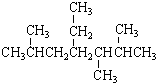 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 石油裂解可以得到氯乙烯,煤液化可得到焦炭、煤焦油、焦炉气等 | |
| D. | 1.0 molHC≡CCHO最多能与3.0 mol H2完全反应 |
19.下列溶液一定呈酸性的是( )
| A. | 滴加酚酞显无色溶液 | B. | 含有较多H+的溶液 | ||
| C. | pH<7的溶液 | D. | c(OH-)<c(H+)的溶液 |
6.下列说法错误的是( )
| A. | 卢瑟福提出了带核的原子结构模型 | |
| B. | 已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,受PM2.5污染的大气不一定能产生丁达尔现象 | |
| C. | 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有的非金属元素 | |
| D. | 并不是所有金属元素都可以用焰色反应来确定其存在 |
3.某澄清溶液可能含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-,现取3份100mL该溶液分别进行如下实验:
试回答下列问题:
(1)根据实验判断混合物中一定存在的离子是K+、NH4+、CO32-、SO42-,无法确定的离子是Cl-.
(2)写出实验2中发生反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(3)为了进一步确定可能存在的离子,请设计可行的实验方案:取少量待测液于试管中滴加稀硝酸酸化,再滴加硝酸银溶液,若产生白色沉淀,则说明原溶液中含有Cl-.
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体0.672L (已折算成标准状况下的体积) |
| 3 | 加足量 BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量的稀盐酸,然后干燥、称量 | 第一次称量读数为4.3g, 第二次称量读数为2.33g |
(1)根据实验判断混合物中一定存在的离子是K+、NH4+、CO32-、SO42-,无法确定的离子是Cl-.
(2)写出实验2中发生反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(3)为了进一步确定可能存在的离子,请设计可行的实验方案:取少量待测液于试管中滴加稀硝酸酸化,再滴加硝酸银溶液,若产生白色沉淀,则说明原溶液中含有Cl-.
4.实验操作的规范是实验的基本要求.下列实验操作正确的是( )
| A. |  给试管加热 | B. |  点燃酒精灯 | C. |  滴加液体 | D. |  称量10.05g固体 称量10.05g固体 |
