题目内容
7.下列情况不能用勒夏特列原理解释的是( )| A. | 利用饱和NaCl溶液除去Cl2中的HCl | |
| B. | 乙酸乙酯在碱性条件下水解更充分 | |
| C. | 工业合成氨反应:N2(g)+3H2(g)?2NH3 (g)△H=-92.4kJ/mol,采用较高的温度下进行 | |
| D. | 接触法制硫酸工业中通入过量空气与SO2反应 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A、增大氯离子的浓度,平衡Cl2+H2O=H++Cl-+HClO,逆向移动使得,氯气难溶于饱和食盐水,能用勒夏特列原理解释,故A错误;
B、乙酸乙酯水解生成羧酸和醇,加入碱性物质,可以和生成的酸之间反应,导致水解平衡正向移动,能用勒夏特列原理解释,故B错误;
C、工业合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,采用较高的温度不利于平衡正向移动,是考虑反应速率和催化剂的活性方面的原因,不能用勒夏特列原理解释,故C正确;
D、根据平衡:2SO2+O2?2SO3,使用过量的空气即增大氧气的量可以使化学平衡正向移动,提高SO2的利用率,能用勒沙特列原理解释,故D错误;
故选C.
点评 本题考查勒夏特里原理,侧重考查基本理论,明确勒夏特里原理适用范围即可解答,会利用勒夏特里原理解释外界条件对化学平衡的影响,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
17.在密闭容器中,对于可逆反应A+3B?2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )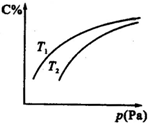

| A. | B一定为气体 | |
| B. | A一定为气体 | |
| C. | 若正反应方向△H<0,则T1>T2 | |
| D. | 压强增大时,混合气体的平均相对分子质量减小 |
18.在无色溶液中能大量共存的离子组是( )
| A. | Na+H+ AlO2- SO32- | B. | NH4+ Al3+SO42-Cl- | ||
| C. | OH- K+ SO42- HCO3- | D. | Fe2+Na+ ClO-NO3- |
15.下列说法不正确的是( )
| A. | 碳酸钠不能用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 切开的金属Na暴露在空气中,光亮表面会逐渐变暗 | |
| C. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| D. | 金属镁在空气中燃烧的产物是纯净的氧化镁 |
19.下列溶液一定呈酸性的是( )
| A. | 滴加酚酞显无色溶液 | B. | 含有较多H+的溶液 | ||
| C. | pH<7的溶液 | D. | c(OH-)<c(H+)的溶液 |
16.下列物质中,含有离子键和共价键的是( )
| A. | HCl | B. | MgO | C. | NaCl | D. | NaOH |
17.下列离子能大量共存的是( )
| A. | 使无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 含有大量BaCl2的溶液中:Mg2+、NH4+、SO42-、NO3- | |
| D. | 使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32-、NO3- |