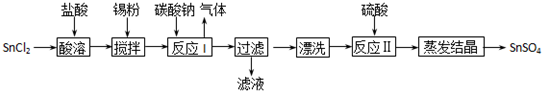
题目内容
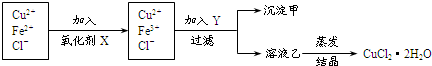
铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4?7H2O)在医药上作补血剂.某课外小组测定该补血剂(每片b克)中铁元素的含量.实验步骤如图所示:
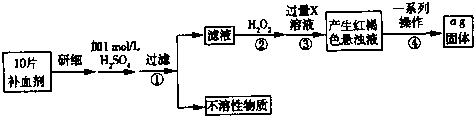
(1)写出步骤②中反应的离子方程式,并用单线桥标出电子转移的数目和方向: .
(2)步骤③中若X为氨水,则检验所得红褐色悬浊液中主要含有阳离子的实验方法是: .
(3)步骤④中一系列处理的操作步骤依次为 、 、灼烧、冷却、称量.
(4)若实验无损耗,则每片补血剂含铁元素的质量分数为 .

(1)写出步骤②中反应的离子方程式,并用单线桥标出电子转移的数目和方向:
(2)步骤③中若X为氨水,则检验所得红褐色悬浊液中主要含有阳离子的实验方法是:
(3)步骤④中一系列处理的操作步骤依次为
(4)若实验无损耗,则每片补血剂含铁元素的质量分数为
考点:物质分离和提纯的方法和基本操作综合应用,氧化还原反应
专题:实验设计题,氧化还原反应专题
分析:由流程图可知,该实验原理为:向药品中加入硫酸,将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,加入过量的氨水,使Fe3+转化为氢氧化铁沉淀,再加热将之转化为氧化铁,通过测定氧化铁的质量,根据元素守恒计算补血剂中铁元素的含量.
(1)双氧水具有强氧化性,能将Fe2+全部氧化为Fe3+;
(2)铵盐可以和强碱之间反应生成碱性气体氨气,据此回答判断;
(3)氢氧化铁沉淀过滤、洗涤、干燥,可以得到氢氧化铁固体,加热,可以得到氧化铁;
(4)根据铁元素守恒来计算.
(1)双氧水具有强氧化性,能将Fe2+全部氧化为Fe3+;
(2)铵盐可以和强碱之间反应生成碱性气体氨气,据此回答判断;
(3)氢氧化铁沉淀过滤、洗涤、干燥,可以得到氢氧化铁固体,加热,可以得到氧化铁;
(4)根据铁元素守恒来计算.
解答:
解:由流程图可知,该实验原理为:向药品中加入硫酸,将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,加入过量的氨水,使Fe3+转化为氢氧化铁沉淀,再加热将之转化为氧化铁,通过测定氧化铁的质量,根据元素守恒计算补血剂中铁元素的含量.
(1)双氧水具有强氧化性,能将Fe2+全部氧化为Fe3+,铁元素的化合价升高值=氧元素的化合价降低值=2,电子转移情况如下 ,故答案为:
,故答案为: ;
;
(2)加入过量的氨水,使Fe3+转化为氢氧化铁沉淀,所得红褐色悬浊液中主要含有阳离子铵根离子,铵根离子实验方法是:过滤取滤液,加NaOH溶液加热,若产生使湿润红色石蕊试纸变蓝的气体,则含NH4+,故答案为:过滤取滤液,加NaOH溶液加热,若产生使湿润红色石蕊试纸变蓝的气体,则含NH4+;
(3)Fe3+转化为氢氧化铁沉淀,将之过滤、洗涤、干燥,可以得到氢氧化铁固体,加热,可以得到氧化铁,故答案为:过滤;洗涤;
(4)得到的ag固体是氧化铁,铁元素的质量是a×
×100%=
g,则每片补血剂含铁元素的质量分数为
×100%=
%,故答案为:
%.
(1)双氧水具有强氧化性,能将Fe2+全部氧化为Fe3+,铁元素的化合价升高值=氧元素的化合价降低值=2,电子转移情况如下
 ,故答案为:
,故答案为: ;
;(2)加入过量的氨水,使Fe3+转化为氢氧化铁沉淀,所得红褐色悬浊液中主要含有阳离子铵根离子,铵根离子实验方法是:过滤取滤液,加NaOH溶液加热,若产生使湿润红色石蕊试纸变蓝的气体,则含NH4+,故答案为:过滤取滤液,加NaOH溶液加热,若产生使湿润红色石蕊试纸变蓝的气体,则含NH4+;
(3)Fe3+转化为氢氧化铁沉淀,将之过滤、洗涤、干燥,可以得到氢氧化铁固体,加热,可以得到氧化铁,故答案为:过滤;洗涤;
(4)得到的ag固体是氧化铁,铁元素的质量是a×
| 112 |
| 160 |
| 7a |
| 10 |
| ||
| 10b |
| 7a |
| b |
| 7a |
| b |
点评:本题是一道物质的分离和提纯的实验方案设计题,考查学生实验分析和探究能力,注意元素守恒思想在计算中的应用,难度中等.

练习册系列答案
相关题目
下列说法中不正确的是( )
| A、糖类是生命的基础能源 |
| B、油脂是人体重要的体内能源 |
| C、蛋白质是生命的基础 |
| D、维生素和微量元素在膳食中可代替糖和油脂 |