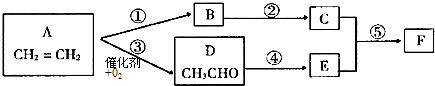
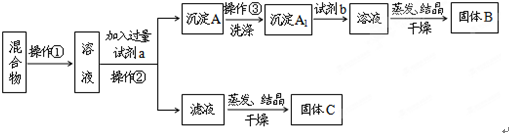
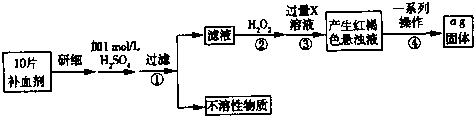
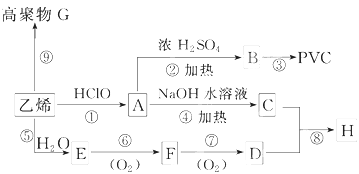
题目内容
钼是银白色高熔点金属,易加工成丝、带、片、棒等,在电子工业中有广泛应用.钼也大量用于制合金钢,可提高钢的耐高温强度、耐磨性、耐腐蚀性等.工业上可由辉钼矿(主要成分为MoS2)提取金属钼,其提炼过程如下:
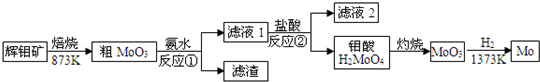
(1)辉钼矿在焙烧前应粉碎,其目的是 .
(2)反应①的化学方程式是 .
(3)反应②的离子方程式是 .
(4)工业上从成本因素考虑,滤液2加入 (填化学式)后可循环利用于反应①.
(5)实验室模拟灼烧钼酸,应该选择的仪器是酒精灯、 、 、三脚架、坩埚钳和玻璃棒.

(1)辉钼矿在焙烧前应粉碎,其目的是
(2)反应①的化学方程式是
(3)反应②的离子方程式是
(4)工业上从成本因素考虑,滤液2加入
(5)实验室模拟灼烧钼酸,应该选择的仪器是酒精灯、
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:辉钼矿焙烧生成MoO3和SO2,MoO3属于酸性氧化物,和氨水反应生成钼酸铵和水,钼酸铵和盐酸反应生成氯化铵和钼酸,过滤得到钼酸,灼烧钼酸得到MoO3,然后用氢气还原MoO3得到金属单质Mo,
(1)反应物的接触面积越大,其反应速率越快,从而缩短反应时间;
(2)MoO3是酸性氧化物,能和NH3?H2O反应生成盐和水;
(3)盐酸的酸性大于钼酸,所以MoO42-和酸反应生成难溶于水的H2MoO4;
(4)滤液2中含有氯化铵,氯化铵和碱反应生成氨气,氨气溶于水得到氨水;
(5)做灼烧实验时需要酒精灯、坩埚、三脚架、泥三角、坩埚钳和玻璃棒.
(1)反应物的接触面积越大,其反应速率越快,从而缩短反应时间;
(2)MoO3是酸性氧化物,能和NH3?H2O反应生成盐和水;
(3)盐酸的酸性大于钼酸,所以MoO42-和酸反应生成难溶于水的H2MoO4;
(4)滤液2中含有氯化铵,氯化铵和碱反应生成氨气,氨气溶于水得到氨水;
(5)做灼烧实验时需要酒精灯、坩埚、三脚架、泥三角、坩埚钳和玻璃棒.
解答:
解:辉钼矿焙烧生成MoO3和SO2,MoO3属于酸性氧化物,和氨水反应生成钼酸铵和水,钼酸铵和盐酸反应生成氯化铵和钼酸,过滤得到钼酸,灼烧钼酸得到MoO3,然后用氢气还原MoO3得到金属单质Mo,
(1)反应物的接触面积越大,其反应速率越快,为增大反应物接触面积,可以将固体粉碎,使反应更充分,从而增大反应速率,提高原料利用率,故答案为:增大固体表面积,增大反应速率,提高原料利用率;
(2)MoO3是酸性氧化物,氨水具有碱性,所以MoO3能和NH3?H2O反应生成盐和水,反应方程式为MoO3+2NH3?H2O═(NH4)2MoO4+H2O,故答案为:MoO3+2NH3?H2O═(NH4)2MoO4+H2O;
(3)盐酸的酸性大于钼酸,根据强酸制取弱酸知,钼酸铵和盐酸发生复分解反应生成难溶性的钼酸和氯化铵,离子方程式为MoO42-+2H+═H2MoO4↓,故答案为:MoO42-+2H+═H2MoO4↓;
(4)滤液2中含有氯化铵,氯化铵能和碱液反应生成氨气,氨气溶于水得到氨水,从而将氨气循环利用,减少成本,Ca(OH)2具有碱性且价格低廉,所以可以用Ca(OH)2和氯化铵制取氨气,故答案为:Ca(OH)2;
(5)做灼烧实验时需要酒精灯进行加热、用坩埚盛放钼酸、用三脚架和泥三角放置坩埚、用坩埚钳夹取坩埚,用玻璃棒搅拌,所以还需要的仪器是坩埚和泥三角,故答案为:坩埚;泥三角.
(1)反应物的接触面积越大,其反应速率越快,为增大反应物接触面积,可以将固体粉碎,使反应更充分,从而增大反应速率,提高原料利用率,故答案为:增大固体表面积,增大反应速率,提高原料利用率;
(2)MoO3是酸性氧化物,氨水具有碱性,所以MoO3能和NH3?H2O反应生成盐和水,反应方程式为MoO3+2NH3?H2O═(NH4)2MoO4+H2O,故答案为:MoO3+2NH3?H2O═(NH4)2MoO4+H2O;
(3)盐酸的酸性大于钼酸,根据强酸制取弱酸知,钼酸铵和盐酸发生复分解反应生成难溶性的钼酸和氯化铵,离子方程式为MoO42-+2H+═H2MoO4↓,故答案为:MoO42-+2H+═H2MoO4↓;
(4)滤液2中含有氯化铵,氯化铵能和碱液反应生成氨气,氨气溶于水得到氨水,从而将氨气循环利用,减少成本,Ca(OH)2具有碱性且价格低廉,所以可以用Ca(OH)2和氯化铵制取氨气,故答案为:Ca(OH)2;
(5)做灼烧实验时需要酒精灯进行加热、用坩埚盛放钼酸、用三脚架和泥三角放置坩埚、用坩埚钳夹取坩埚,用玻璃棒搅拌,所以还需要的仪器是坩埚和泥三角,故答案为:坩埚;泥三角.
点评:本题考查物质分离和提纯,侧重考查学生对实验的整体把握,知道常见仪器的作用、常用的分离和提纯方法、元素化合物的性质,能从整体上分析解答问题,题目难度中等.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
下列说法正确的是( )
| A、12 g金刚石和足球烯(C60)的混合物中含有NA个碳原子 |
| B、2 molCH4的摩尔质量是32 g?mol-1 |
| C、标准状况下2.24 L H2O中含有0.1 NA个氧原子 |
| D、4 g NaOH溶解在100 mL水中配成1 mol?L-1NaOH溶液 |