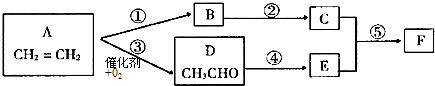
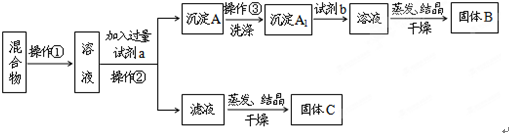
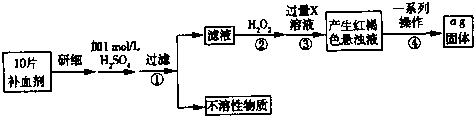
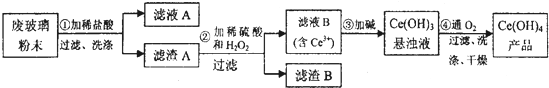
题目内容
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)已知:2SO2(g)+O2(g)?2SO3(g)△H1=-196.6kJ?mol-1
2NO(g)+O2(g)?2NO2(g)△H2=-113.0kJ?mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H= kJ?mol-1.
(2)在2L密闭容器内,800℃时反应2NO2?2NO(g)+O2(g) (g)体系中,n(NO2)随时间的变化如下表:
①已知:K400℃>K350℃,则该反应是 热反应.
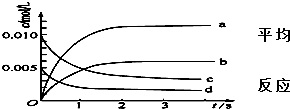
②下图中表示NO的变化的曲线是 .用O2表示从0~2s内该反应的平均速率v= .
③为了使该反应速率增大,且平衡向正反应方向移动的是
a.及时分离出NO气体 b.适当的升高温度 c.增大NO2的浓度 d.增大压强.
(1)已知:2SO2(g)+O2(g)?2SO3(g)△H1=-196.6kJ?mol-1
2NO(g)+O2(g)?2NO2(g)△H2=-113.0kJ?mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=
(2)在2L密闭容器内,800℃时反应2NO2?2NO(g)+O2(g) (g)体系中,n(NO2)随时间的变化如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
②下图中表示NO的变化的曲线是
③为了使该反应速率增大,且平衡向正反应方向移动的是
a.及时分离出NO气体 b.适当的升高温度 c.增大NO2的浓度 d.增大压强.

考点:化学平衡的影响因素,反应速率的定量表示方法,化学平衡常数的含义
专题:
分析:(1)利用盖斯定律计算反应热;
(2)①K随温度的升高而增大,说明升温时平衡正向移动;
②反应开始时n(NO2)=0.02mol,其浓度为:0.01mol/L,且与NO的反应速率之比为1:1,据此分析;据v(O2)=
计算反应速率;
③为使该反应的反应速率增大,可采用增大压强、升高温度、加入催化剂、增大反应物浓度等方法,再结合平衡移动原理分析解答.
(2)①K随温度的升高而增大,说明升温时平衡正向移动;
②反应开始时n(NO2)=0.02mol,其浓度为:0.01mol/L,且与NO的反应速率之比为1:1,据此分析;据v(O2)=
| ||
| △t |
③为使该反应的反应速率增大,可采用增大压强、升高温度、加入催化剂、增大反应物浓度等方法,再结合平衡移动原理分析解答.
解答:
解:(1)已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1,利用盖斯定律将①×
-②×
得NO2(g)+SO2(g)?SO3(g)+NO(g)
△H=
×(-196.6kJ?mol-1)-
×(-113.0kJ?mol-1)=-41.8kJ?mol-1,
故答案为:-41.8;
(2)①K随温度的升高而增大,说明升温时平衡正向移动,正反应吸热,故答案为:吸;
②根据二氧化氮物质的量的变化知,该反应向正反应方向移动,则一氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮增大的物质的量等于二氧化氮减小的物质的量,所以表示NO的变化的曲线是b,
0~2s内v(NO2)=
=0.0030mol/(L.min),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以氧气的反应速率为 0.0015mol/(L?s),
故答案为:b;0.0015mol/(L?s);
③a.及时分离除NO2气体平衡向右移动,但反应速率减小,故错误;
b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故错误;
c.增大NO2的浓度反应速率增大,且该反应向正反应方向移动,故正确;
d.增大压强反应速率增大,平衡逆向移动,故错误;
故选c.
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1,利用盖斯定律将①×
| 1 |
| 2 |
| 1 |
| 2 |
△H=
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:-41.8;
(2)①K随温度的升高而增大,说明升温时平衡正向移动,正反应吸热,故答案为:吸;
②根据二氧化氮物质的量的变化知,该反应向正反应方向移动,则一氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮增大的物质的量等于二氧化氮减小的物质的量,所以表示NO的变化的曲线是b,
0~2s内v(NO2)=
| ||
| 2 |
故答案为:b;0.0015mol/(L?s);
③a.及时分离除NO2气体平衡向右移动,但反应速率减小,故错误;
b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故错误;
c.增大NO2的浓度反应速率增大,且该反应向正反应方向移动,故正确;
d.增大压强反应速率增大,平衡逆向移动,故错误;
故选c.
点评:本题考查了反应热的判断、反应速率的计算、影响反应速率及平衡移动的因素,题目难度不大.

练习册系列答案
相关题目
2010年诺贝尔化学奖授予在“钯催化交叉偶联”反应领域作出突出贡献的三位科学家,下列有关钯原子
Pd的说法错误的是( )
106 46 |
| A、质量数为106 |
| B、质子数为46 |
| C、电子数为60 |
| D、中子数为60 |
下列化学用语中,正确的是( )
A、Mg原子结构示意图  | ||||
| B、两个硫酸根离子:SO42- | ||||
C、质子数为6、中子数为8的碳原子:
| ||||
| D、三个氧原子:3O3 |