题目内容
工业上制取纯净CuCl2?2H2O的主要过程是:①将粗CuO(含少量Fe)溶解于足量稀盐酸中,加热、冷却、过滤,调节滤液的pH为3;②对①的滤液进行下列操作:
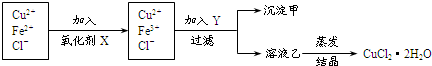
已知Cu2+、Fe2+在pH为4~5时不会形成氢氧化物沉淀,而Fe3+却几乎完全水解而沉淀.请回答下列有关问题:
(1)X最好是 (填序号).
A.KMnO4 B.HNO3(稀) C.H2O2 D.HNO3(浓)
其反应的离子方程式为 .
(2)Y物质可以选用下列物质中的 (填序号).
A.NaOH溶液 B.浓氨水 C.CuO D.CuCO3
(3)用惰性电极电解溶液乙时,阳极反应式为 .
(4)若将溶液乙蒸干并灼烧,得到的固体物质为 (填化学式);因此,在对溶液C蒸发结晶时应注意 .

已知Cu2+、Fe2+在pH为4~5时不会形成氢氧化物沉淀,而Fe3+却几乎完全水解而沉淀.请回答下列有关问题:
(1)X最好是
A.KMnO4 B.HNO3(稀) C.H2O2 D.HNO3(浓)
其反应的离子方程式为
(2)Y物质可以选用下列物质中的
A.NaOH溶液 B.浓氨水 C.CuO D.CuCO3
(3)用惰性电极电解溶液乙时,阳极反应式为
(4)若将溶液乙蒸干并灼烧,得到的固体物质为
考点:物质分离和提纯的方法和基本操作综合应用,电解原理
专题:实验设计题
分析:①的滤液中含有亚铁离子、铜离子、氯离子,加入氧化剂将亚铁离子氧化成铁离子,然后加入Y调节溶液的pH,将铁离子转化成氢氧化铁沉淀除去,得到的溶液乙为氯化铜溶液,然后在持续通入HCl气体并不断搅拌条件下蒸发溶液乙获得氯化铜晶体,
(1)依据流程图可知实验目的是制备氯化铜晶体,需要除去亚铁离子,加入的X为氧化剂,但不能引入新的杂质,据此判断X;双氧水与亚铁离子发生氧化还原反应生成 铁离子和水;
(2)Y物质应调节溶液的酸性,调节溶液PH时铁离子全部沉淀,铜离子不能沉淀且不能引入新的杂质离子;
(3)根据制备流程可知,溶液乙为氯化铜溶液,电解氯化铜溶液时阳极氯离子失去电子生成氯气;
(4)氯化铜水溶液蒸发浓缩,铜离子水解,生成的氯化氢挥发,加热促进水解正向进行,得到氢氧化铜,灼烧后生成氧化铁;所以在对溶液C蒸发结晶时需要在氯化氢气流中蒸发析出晶体.
(1)依据流程图可知实验目的是制备氯化铜晶体,需要除去亚铁离子,加入的X为氧化剂,但不能引入新的杂质,据此判断X;双氧水与亚铁离子发生氧化还原反应生成 铁离子和水;
(2)Y物质应调节溶液的酸性,调节溶液PH时铁离子全部沉淀,铜离子不能沉淀且不能引入新的杂质离子;
(3)根据制备流程可知,溶液乙为氯化铜溶液,电解氯化铜溶液时阳极氯离子失去电子生成氯气;
(4)氯化铜水溶液蒸发浓缩,铜离子水解,生成的氯化氢挥发,加热促进水解正向进行,得到氢氧化铜,灼烧后生成氧化铁;所以在对溶液C蒸发结晶时需要在氯化氢气流中蒸发析出晶体.
解答:
解:根据题中信息可知,①的滤液中含有亚铁离子、铜离子、氯离子,加入氧化剂将亚铁离子氧化成铁离子,然后加入Y调节溶液的pH,将铁离子转化成氢氧化铁沉淀除去,得到的溶液乙为氯化铜溶液,然后在持续通入HCl气体并不断搅拌条件下蒸发溶液乙获得氯化铜晶体,
(1)依据流程图可知实验目的是制备氯化铜晶体,需要除去亚铁离子,加入的X为氧化剂,但不能引入新的杂质,高锰酸钾、浓硝酸和稀硝酸都会引进新的杂质,甚至产生污染物,而双氧水具有强氧化性,且反应后生成水,则双氧水为最佳试剂,故C正确;
双氧水与亚铁离子反应的离子方程式为:2H++H2O2+2Fe2+=2Fe3++2H2O,
故答案为:C;2H++H2O2+2Fe2+=2Fe3++2H2O;
(2)Y物质应调节溶液的酸性,调节溶液PH时铁离子全部沉淀,铜离子不能沉淀且不能引入新的杂质离子,实验需要加入和酸反应的固体物质,如CuO或Cu(OH)2、CuCO3;由于氨水和氢氧化钠会引进新的杂质离子,则Y物质不能选用氨水和氢氧化钠,所以CD正确,
故答案为:CD;
(3)乙溶液为氯化铜溶液,用惰性电极电解氯化铜溶液,阳极氯离子失去电子生成氯气,电极反应式为:2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
(4)氯化铜水溶液蒸发浓缩,铜离子水解,CuCl2+H2O?Cu(OH)2+2HCl,生成的氯化氢挥发,加热促进水解正向进行,得到氢氧化铜,灼烧后得到的固体为CuO,所以实验需要在氯化氢气流中蒸发,抑制水解反应进行,析出得到氯化铜晶体,
故答案为:CuO;持续通入HCl气体并不断搅拌,且溶液不能蒸干.
(1)依据流程图可知实验目的是制备氯化铜晶体,需要除去亚铁离子,加入的X为氧化剂,但不能引入新的杂质,高锰酸钾、浓硝酸和稀硝酸都会引进新的杂质,甚至产生污染物,而双氧水具有强氧化性,且反应后生成水,则双氧水为最佳试剂,故C正确;
双氧水与亚铁离子反应的离子方程式为:2H++H2O2+2Fe2+=2Fe3++2H2O,
故答案为:C;2H++H2O2+2Fe2+=2Fe3++2H2O;
(2)Y物质应调节溶液的酸性,调节溶液PH时铁离子全部沉淀,铜离子不能沉淀且不能引入新的杂质离子,实验需要加入和酸反应的固体物质,如CuO或Cu(OH)2、CuCO3;由于氨水和氢氧化钠会引进新的杂质离子,则Y物质不能选用氨水和氢氧化钠,所以CD正确,
故答案为:CD;
(3)乙溶液为氯化铜溶液,用惰性电极电解氯化铜溶液,阳极氯离子失去电子生成氯气,电极反应式为:2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
(4)氯化铜水溶液蒸发浓缩,铜离子水解,CuCl2+H2O?Cu(OH)2+2HCl,生成的氯化氢挥发,加热促进水解正向进行,得到氢氧化铜,灼烧后得到的固体为CuO,所以实验需要在氯化氢气流中蒸发,抑制水解反应进行,析出得到氯化铜晶体,
故答案为:CuO;持续通入HCl气体并不断搅拌,且溶液不能蒸干.
点评:本题考查了物质制备实验方案的设计、物质的分离与提纯方法综合应用,题目难度中等,明确制备流程及反应原理为解答关键,需要注意除杂不能引入新的杂质,试题侧重考查学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
经分析,某物质中只有一种元素,则此物质( )
| A、一定是一种单质 |
| B、一定是纯净物 |
| C、一定是混合物 |
| D、可能是纯净物也可能是混合物 |
下列化学用语中,正确的是( )
A、Mg原子结构示意图  | ||||
| B、两个硫酸根离子:SO42- | ||||
C、质子数为6、中子数为8的碳原子:
| ||||
| D、三个氧原子:3O3 |
某同学设计如下实验测量m g铜银合金样品中铜的质量分数.
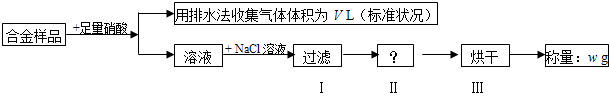
下列说法中不正确的是( )

下列说法中不正确的是( )
| A、收集到的V L气体全为 NO | ||
| B、过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒 | ||
| C、操作Ⅱ应是洗涤 | ||
D、铜的质量分数为:
|
生活中的一些问题常涉及到化学知识,下列叙述不正确的是( )
| A、淀粉、纤维素都是天然有机高分子化合物 |
| B、禁止使用含铅汽油是为了提高汽油的燃烧效率 |
| C、食用植物油的重要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质 |
| D、苯酚有毒,但苯酚稀溶液可用于杀菌消毒 |